Autores
- PAOLUCCI, ESTEBAN MARCELO
- (1) MUSEO ARGENTINO DE CIENCIAS NATURALES “BERNARDINO RIVADAVIA” - CONICET, FACULTAD DE CIENCIAS EXACTAS Y NATURALES, UBA. BUENOS AIRES, ARGENTINA.
La variabilidad fenotípica, tanto basada en plasticidad fenotípica como en diversidad genética, puede tener una gran importancia durante el proceso de invasión de las especies exóticas. Limnoperna fortunei (Dunker, 1857) fue introducido en Sudamérica alrededor de 1990, en el estuario del Río de la Plata, Argentina, desde donde se expandió rápidamente hasta abarcar prácticamente toda esta cuenca y otras aledañas. Sin embargo, algunos ambientes no han sido colonizados y, presumiblemente, la supervivencia de esta especie se vio afectada por distintos factores ambientales como los sólidos en suspensión, la salinidad, y la contaminación.
L. fortunei evidenció una alta variabilidad genética y morfológica, mostrando una distribución fuertemente afectada por las actividades humanas y por sus vectores de dispersión. El grado de variabilidad fenotípica estaría jugando un papel fundamental en su establecimiento, o no, en los diferentes ambientes. Las variaciones morfológicas y metabólicas, incluyendo cambios en la tasa de crecimiento, desarrollo de órganos internos o cambios en la tasa de filtrado y respiración en áreas límite de su distribución o bajo condiciones ambientales extremas, permitirían explicar, junto con otras variables como la presencia de vectores de dispersión, el patrón de distribución actual.
PALABRAS CLAVE: ecofisiología, especies exóticas, distribución, mejillón dorado, morfología.
A variabilidade fenotípica, tanto baseada na plasticidade fenotípica quanto na diversidade genética, pode ser um dos principais fatores que afetam o processo de invasão de espécies exóticas. Limnoperna fortunei (Dunker, 1857) foi introduzido na América do Sul por volta de 1990, no estuário do Río de la Plata, Argentina, de onde se espalhou rapidamente para cobrir a maior parte da bacia e outras bacias hidrográficas menores. No entanto, alguns ambientes não foram colonizados e, presumivelmente, a sobrevivência desta espécie foi afetada por diferentes fatores ambientais, como sólidos em suspensão, salinidade e poluição.
L. fortunei apresentou alta variabilidade genética e morfológica, apresentando uma distribuição fortemente afetada pelas atividades humanas e seus vetores de dispersão. O grau de variabilidade fenotípica estaria desempenhando um papel fundamental no seu estabelecimento, ou não, nos diferentes ambientes. Variações morfológicas e metabólicas, incluindo alterações na taxa de crescimento, desenvolvimento dos órgãos internos ou alterações na taxa de filtração e respiração em áreas fronteiriças de sua distribuição ou sob condições ambientais extremas, permitiriam explicar, em conjunto com outras variáveis como a presença de vetores de dispersão, o padrão de distribuição atual.
PALAVRAS-CHAVE: ecofisiologia, espécie exótica, distribuição, mexilhãodourado, morfologia.
Introducción
Una vez introducida y establecida una especie exótica, el proceso de colonización de un nuevo ambiente es un fenómeno complejo que depende de múltiples factores antrópicos y ambientales, así como de características intrínsecas de la especie introducida (Blackburn, et al., 2011). Aunque realizar generalizaciones acerca de estas características resulta difícil pues su valor parece relativo al contexto ambiental (Boltovskoy, et al., 2020), la variabilidad genética y fenotípica puede determinar la extensión y diversidad de ambientes a colonizar (Sax, et al., 2007; Kelley, 2014). Sin embargo, también se ha cuestionado el valor mismo de la diversidad genética y plasticidad fenotípica para las especies invasoras (Drown, et al., 2011; Davidson, et al., 2011), dada la existencia de exitosos invasores resistentes a ambientes extremos (Paolucci y Thuesen, 2020; Rabushko, et al., 2020), pero con muy baja variabilidad genética y plasticidad fenotípica, aparentemente similar a la de especies nativas coexistentes (Levri, et al., 2014). En paralelo, la presión de propágulos, es decir la magnitud y el número de eventos de introducción, puede ser determinante no solo en la introducción inicial sino también en la dispersión a nuevos ambientes, ya que abarca tanto las características biológicas como la presencia de vectores de dispersión (Lockwood, et al., 2009). Este proceso no es irreversible; aunque los ejemplos son escasos, Blackburn y otros (2011) describen detalladamente el retroceso y la desaparición de especies exóticas, incluyendo explícitamente la posibilidad de fallas en cualquier etapa de la colonización.
En este contexto, el estudio del grado de variabilidad genética, morfológica y metabólica de una especie invasora ayuda a comparar la importancia relativa de estos factores frente a otros como la presión de propágulos, y así comprender cuáles son los determinantes de ese proceso de invasión en particular. El presente trabajo expone los últimos reportes sobre la distribución del bivalvo exótico Limnoperna fortunei (Dunker, 1857) en Sudamérica, recopilando las evidencias sobre variabilidad morfológica y metabólica que podrían facilitar o condicionar la colonización de diversos ambientes. Frente a la expansión de la distribución de esta especie exótica, ya reiteradamente predicha (Oliveira, et al., 2015), se estudian las variables que puedan sustentar o limitar la expansión y mitigar el impacto de esta especie. Se analizan datos publicados e inéditos acerca de variaciones morfológicas y metabólicas de relevancia en la supervivencia en los ecosistemas colonizados, y se discute la potencial plasticidad fenotípica de esta especie en el marco de la variabilidad genética reportada.
Bivalvos exóticos y plasticidad fenotípica
Las variaciones morfológicas y metabólicas observadas en bivalvos en general demuestran la gran capacidad de estos organismos para establecerse en nuevos ambientes (McLachlan, et al., 1995; Soares, et al., 1998); incluyendo numerosos ejemplos de especies invasoras como las almejas asiáticas Corbicula fluminea y C. larguillerti, el mejillón cebra Dreissena polymorpha, el mejillón quagga D. rostriformis bugensis, y la ostra japonesa Crassostrea gigas, entre otros (Alexander, et al., 1994; Marsden, et al., 1996; Sousa, et al., 2007; Dutertre, et al., 2009; Peyer, et al., 2010). En varios de estos estudios se probó que la plasticidad fenotípica fue uno de los mecanismos más importantes que permitió una rápida respuesta a las diferentes y cambiantes condiciones ambientales.
La plasticidad fenotípica en bivalvos se ve reflejada en cambios en la morfología de las valvas, en órganos paliares como el área branquial o en los palpos labiales como respuesta a las distintas condiciones ambientales (Payne, et al., 1995; Lei, et al., 1996; Peyer, et al., 2010). Particularmente, en los moluscos lamelibranquios se observan cambios morfológicos en respuesta a variaciones en la cantidad y el tipo de alimento, los sedimentos en suspensión y otras variables ambientales que pueden afectar su capacidad de filtración. Por ejemplo, una disminución en el área branquial y un incremento en el área de los palpos labiales se ha asociado a ambientes de alta turbidez (Drent, et al., 2004; Dutertre, et al., 2009). Según dichos autores, estos cambios representarían una ventaja al evitar el daño de las branquias por el material en suspensión, e incrementarían la capacidad de seleccionar el alimento, función atribuida a los palpos labiales en moluscos. Una mayor área branquial ha sido observada en bivalvos establecidos en ambientes de baja concentración de oxígeno (Scott, 2005), siendo frecuente asumir que una mayor superficie de filtración incrementa la capacidad respiratoria y de alimentación, lo que podría considerarse como una respuesta adaptativa a las condiciones ambientales (Alexander, et al., 1994; Lei, et al., 1996).
Por otro lado, también se han observado en moluscos en general, y particularmente en bivalvos exóticos, respuestas metabólicas y fisiológicas frente a cambios ambientales tales como cambios en la temperatura, salinidad, disponibilidad de alimentos y otros (Fanslow, et al., 2001; Hamdoun, et al., 2003; Barrento, et al., 2013; Tyner, et al., 2015). Se ha estudiado la relación entre la tolerancia a cambios térmicos y la expresión de genes relacionados con la síntesis de proteínas de shock térmico (HSP70) en distintas especies exóticas, demostrando la base genética para la plasticidad metabólica como respuesta a condiciones de estrés (Hamdoun, et al., 2003; Kelley, 2014).
Limnoperna fortunei: llegada, dispersión y distribución de un molusco exótico en Sudamérica
La invasión del bivalvo exótico Limnoperna fortunei en Sudamérica comenzó alrededor de 1990, cuando se detectó por primera vez en el estuario del Río de la Plata, Argentina, probablemente introducido por agua de lastre de barcos comerciales provenientes del sudeste de Asia (Darrigran y Pastorino, 1995). En 2015, Oliveira y otros publicaron una actualización de la distribución de L. fortunei en Sudamérica, la cual incluía casi todos los principales cuerpos de agua de la Cuenca del Río de la Plata, al igual que otras cuencas vecinas como Guaiba, Tramandai, Patos-Mirim, y Mar Chiquita (Figura 1). Durante los primeros años del proceso de invasión, la dispersión fue rápida -alcanzando valores de hasta 250 km por año-, en gran medida determinada por el transporte río arriba a través de embarcaciones en la Hidrovía Paraná-Paraguay (Darrigran y Pastorino, 2004; Boltovskoy, et al., 2006; Oliveira, et al., 2011).
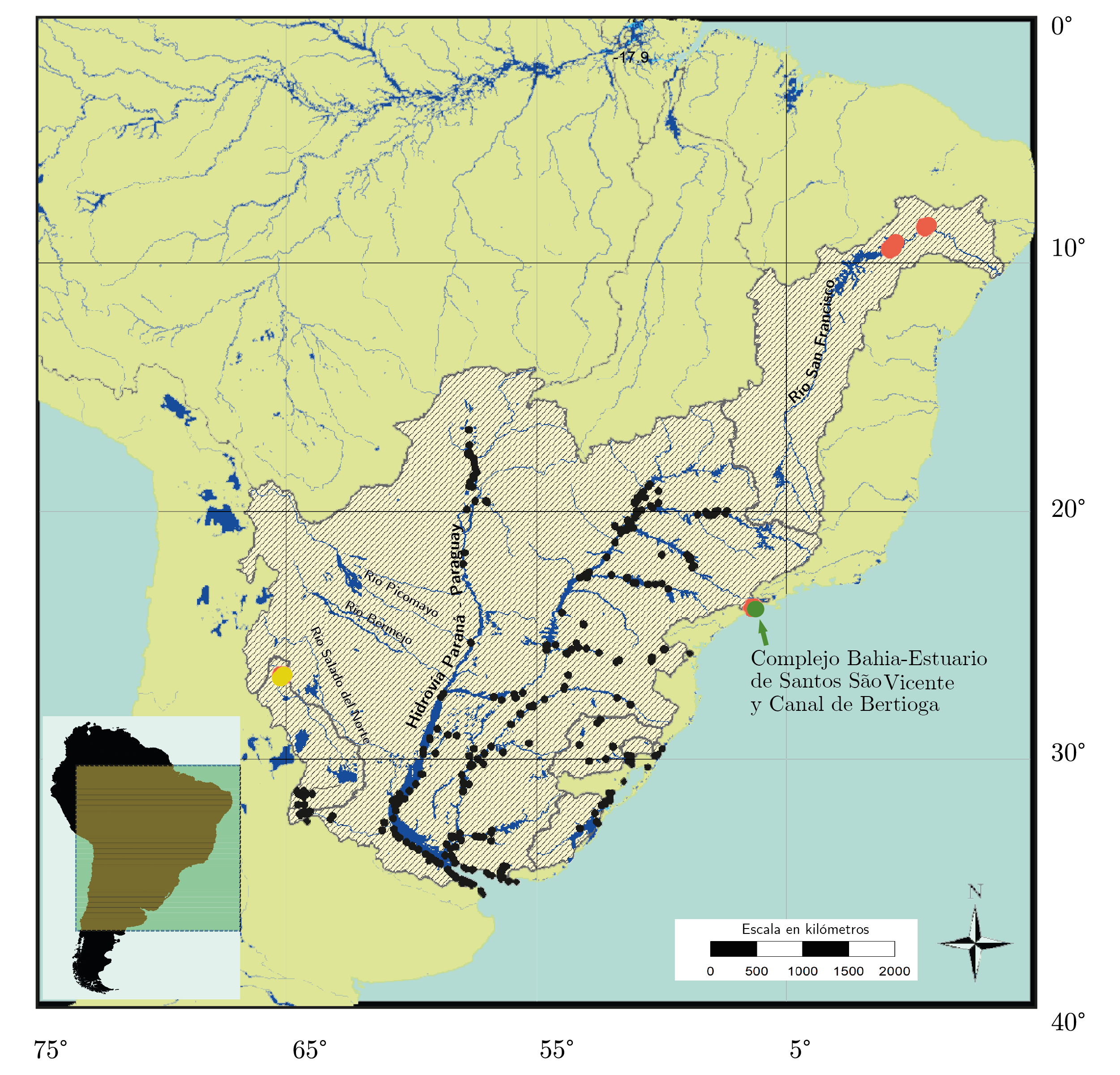
Figura 1. Mapa de distribución de Limnoperna fortunei en Sudamérica (Modificado de Oliveira, et al., 2015, puntos negros), con nuevos registros de la especie en Brasil, puntos rojos y verdes, reportados por Barbosa y otros (2016) y Senskey otros (2019) respectivamente, y nuevos reportes en Argentina (punto amarillo, Anónimo, 2019).
Ya en 1998, L. fortunei había sido registrada a más de 3.400 kilómetros aguas arriba del lugar de introducción, en el río Paraguay Superior, uno de los principales cursos de la Cuenca del Río de la Plata (Oliveira, et al., 2015). Dada esta velocidad de dispersión, se sugirió que la especie podría avanzar río arriba colonizando ambientes conectados a los afluentes y lagunas asociadas al río Paraguay, pudiendo alcanzar incluso afluentes y cursos de agua de la cuenca del Amazonas (Uliano-Silva, et al., 2013). Sin embargo, una menor intensidad del tránsito naviero (solo embarcaciones menores de tránsito local) y condiciones ambientales adversas (ambientes anóxicos; Oliveira, et al., 2010) podrían disminuir considerablemente tanto la presión de propágulo como su supervivencia fuera de los cursos principales, y consecuentemente la expansión de L. fortunei. Aunque se ha reportado una tolerancia a la anoxia relativamente mayor a otras especies de bivalvos invasores (Karatayev, et al., 2015), los eventos de anoxia extrema detectados en las lagunas conectadas al canal principal del río Paraguay parecen producir grandes mortandades en larvas y adultos de L. fortunei y, aparentemente, limitar su distribución (Oliveira, et al., 2010; Pessotto y Nogueira, 2018).
L. fortunei continuó expandiendo su distribución hacia el norte y fue reportada en cuencas vecinas, incluyendo las del río San Francisco (Barbosa, et al., 2016), del Complejo Bahía-Estuario de Santos, São Vicente y del Canal de Bertioga (Senske, et al., 2019), estas dos últimas en Brasil (Figura 1). Su presencia en estas cuencas parece más relacionada a una introducción secundaria, producto de la actividad de algún vector de introducción más que a una expansión natural de la distribución; por ejemplo, el agua de lastre para el caso del Complejo Bahía-Estuario de Santos, São Vicente y del Canal de Bertioga (Senske, et al., 2019). Esta expansión hacia el norte en zonas tropicales contrasta con la falta de nuevos registros hacia el límite sur de su distribución en Sudamérica, donde hasta al momento no se han registrado ríos ni otros cuerpos de agua colonizados por L. fortunei.
Elevados valores de salinidad marcan un límite de distribución para esta especie dulceacuícola, y el efecto de esta variable sobre la mortalidad de L. fortunei fue estudiado reproduciendo las fluctuaciones de salinidad típicas del estuario del Río de la Plata, tolerando hasta un 23% de salinidad (Sylvester, et al., 2013). Dicha tolerancia cae a 2% en condiciones de exposición constante (Angonesi, et al., 2008). Este factor estaría limitando su distribución, es decir, permitiendo colonizar solo parcialmente distintos ambientes costeros como la Laguna Los Patos (Barbosa y Melo, 2009), el complejo estuarino São Vicente y el Canal de Bertioga (Senske, et al., 2019), o el propio Río de la Plata (Sylvester, et al., 2013). Sin embargo, parece interesante destacar la diferencia en la tolerancia a valores altos de salinidad observada al comparar los trabajos de Sylvester y otros (2013) y Angonesi y otros (2008). En el primer estudio, la mayor supervivencia reportada por exposición discontinua a valores altos de salinidad se basaría, según los autores, en la capacidad de esta especie de modificar su comportamiento cerrando las valvas como respuesta a las condiciones adversas (Cataldo, et al., 2003). Este comportamiento flexible, así como quizás otros mecanismos de compensación osmótica no suficientemente estudiados (Deaton, et al., 1989), permitirían a esta especie sobrevivir en ambientes de salinidad intermedia, los cuales suelen poseer gran actividad naviera y portuaria con la consecuente importancia en la dispersión de esta especie hacia otros ambientes, como fue analizado por Sylvester y otros (2013).
Otros saltos menores en la distribución se observaron en Argentina, donde a fines de 2019 personal del Instituto de Biodiversidad Tropical y de la Dirección de Flora y Fauna de la Provincia de Tucumán reportaron a los medios locales la presencia de esta especie en el Dique Celestino Gelsi (El Cadillal, Tucumán), ubicado sobre el río Salí, y en un tributario de éste, el río Loro (Figura 1) (Anónimo, 2019). Estos ríos forman parte de una cuenca endorreica que desemboca en la Laguna de Mar Chiquita, junto con otros ríos como el Primero y Segundo, donde ya se había reportado previamente la presencia de L. fortunei en el año 2006 (Oliveira, et al., 2015). Sin embargo, aunque todos estos cuerpos de agua son afluentes de la mencionada laguna, la intermitencia de los mismos y la elevada salinidad de la Laguna de Mar Chiquita, que varía entre 24.8 y 360.3 g/L (Reati, et al., 1996), probablemente estén limitando la expansión dentro de la cuenca, tal como fue observado en otras cuencas vecinas (Darrigran, et al., 2011). De hecho, es altamente probable que este salto en la distribución se haya producido por la actividad de vectores locales como botes de pescadores y de recreación, que le permitieron a Limnoperna saltar las barreras ambientales existentes. Estas mismas barreras naturales para la dispersión de L. fortunei, sumadas a la gran cantidad de sedimentos en suspensión, fueron propuestas para diversos tributarios andinos de la Cuenca del Plata, como los ríos Salado del Norte, Bermejo y Pilcomayo (Darrigran, et al., 2011), que no han sido colonizados a pesar de tener conexión directa con otros cuerpos de agua de la cuenca donde se reportan poblaciones permanentes del bivalvo.
Por el contrario, se han registrado algunos casos de fracaso en la colonización o retroceso significativo de las poblaciones de Limnoperna en ambientes donde se había reportado esta especie, como es el caso de los embalses Piraquara I y Guaricana, en la Alta Cuenca del río Iguazú, Brasil (Frehse, et al., 2018), y el Embalse Río Tercero en Córdoba, Argentina (Mariñelarena, et al., 2016). En el primer caso, se trató de solo cinco individuos adultos reportados por Takeday y otros (2003), de los cuales desafortunadamente no se proveen más datos que permitan chequear el estado de los individuos ni confirmar su identidad. Es más, sucesivos estudios en los mismos cuerpos de agua no lo pudieron confirmar -incluso analizando el ADN mitocondrial extraído del total de las muestras de plancton colectadas-, quedando esta especie limitada al tramo inferior del río Iguazú (Pestana, et al., 2010; Borges, et al., 2017; Frehse, et al., 2018). A pesar de haberse reportado como un caso fallido de invasión, la escasa cantidad de organismos reportados inicialmente y la escasa información sobre los mismos impiden realizar un análisis más profundo de la dinámica de dispersión y posible colonización en estos cuerpos de agua. Probablemente más estudios sean necesarios para conocer si L. fortunei está presente en la zona, tal vez como poblaciones reducidas aun en periodo de latencia. Por otro lado, el Embalse Río Tercero, uno de los ambientes donde más detalladamente se estudiaron las densidades de L. fortunei mediante muestreos intensivos realizados por buzos, mostró una gran abundancia 10 años después de la colonización de este ambiente (Boltovskoy, et al., 2009a). La distribución reportada no fue uniforme, los sustratos rocosos alcanzaron densidades promedio de hasta 4.867 ind.m-2, entre 0 y 10 metros de profundidad, mientras que en otros sustratos o a mayores profundidades las densidades fueron mucho menores o incluso nulas. Según este estudio, llevó entre cuatro y ocho años, desde el momento de su introducción en 1998, alcanzar las densidades observadas (en promedio 959 ind.m-2) para este embalse de 0.48 km3, con amplia disponibilidad de sustratos duros para ser colonizados y escasa presencia de peces u otros depredadores. Más recientemente se comenzó a registrar una disminución sustancial de las colonias de L. fortunei (Mariñelarena, et al., 2016; Correa, et al., 2015). Aunque no se realizó un nuevo estudio reportando las densidades de las poblaciones en este ambiente, las colonias parecen haber desaparecido de las zonas donde solían ser abundantes en comparación con lo observado durante los primeros años de la invasión (Miguel Hechem com. pers.; Mongi, 2019; Correa, et al., 2015). Sin embargo, es necesario confirmar esta tendencia e investigar más profundamente sus causas, entre las cuales se ha mencionado la disminución del nivel del agua (Correa, et al., 2015). Con solo dos bajantes pronunciadas del nivel del embalse confirmadas durante el periodo analizado no es posible realizar una cuantificación objetiva del impacto en las poblaciones del bivalvo invasor (Correa, et al., 2015). En caso de confirmarse esta disminución poblacional, podría tratarse también de una fase normal en la dinámica de colonización conocida como boom-bust y definida por Strayer y otros (2017) como un crecimiento exponencial seguido de una rápida disminución para alcanzar una densidad poblacional más estable o incluso desaparecer.
Un factor biológico mencionado como potencialmente capaz de limitar la abundancia y/o distribución de esta especie es la presencia de depredadores, en particular peces (Paolucci, et al., 2007; Sylvester, et al., 2007; Nakano, et al., 2010; González‐Bergonzoni, et al., 2020). Se han registrado alrededor de 50 especies de peces, tanto larvas como juveniles y adultos (Cataldo, 2015; Paolucci y Thuesen, 2015; González‐Bergonzoni, et al., 2020), incluso en algunos casos consumiendo de manera preferencial (Paolucci, et al., 2010; Paolucci, et al., 2015; Paolucci, et al., 2017). Sin embargo, el efecto en los casos más extremos parece ser una disminución de la abundancia de L. fortunei que no resulta suficiente para impedir su avance o, más aún, producir su erradicación.
Respuestas morfológicas a los cambios ambientales
Limnoperna fortunei ha colonizado una gran diversidad de ambientes y, al menos con los estudios realizados hasta la fecha, ha fallado en colonizar otros. Sin embargo, a diferencia de lo que se ha descripto para otros bivalvos invasores, poco se conoce acerca de la respuesta fenotípica a condiciones ambientales adversas y cómo esta respuesta -junto a otros elementos clave como la capacidad de dispersión y la presencia de vectores- podría afectar su distribución. Un primer estudio a nivel regional en Sudamérica (Paolucci, et al., 2014b) permitió detectar variaciones morfológicas en esta especie, basadas mayormente en cambios en las proporciones ancho-largo y ancho-alto de sus valvas (Figura 2a). Más aún, mostró que esas variaciones parecen tener un efecto importante a nivel del desarrollo interno, afectando mayormente al área branquial relativa (definida en función del área total del organismo para incluir la variación por tamaño: Figura 2b). Algunas poblaciones mostraron alta proporción de mejillones de mayor relación ancho/largo, resultando en mejillones menos alargados que las proporciones normales (Figura 2c) descriptas originalmente para esta especie (Morton, 1973). Aunque las poblaciones analizadas por los autores resultaron de gran heterogeneidad, abarcando diversidad de ambientes y características, tres factores fueron destacados por los análisis como aparentemente relevantes para describir estas variaciones: los sólidos totales en suspensión, probablemente la baja concentración de oxígeno disuelto o la elevada contaminación registrada en algunas de las poblaciones estudiadas en el Río de la Plata (QU, BU, y PL en la figura 2b y 2c correspondientes a las poblaciones de Quilmes, Buenos Aires y Punta Lara). Desde el punto de vista de la morfología de las valvas, las poblaciones parecen agruparse en dos morfologías distintivas, con mejillones más alargados (poblaciones marcadas en negro en la Figura 2) y mejillones más anchos y cortos (poblaciones marcadas en rojo, Figura 2) con un diferente desarrollo branquial. Al comparar la variación morfológica con la estructura genética poblacional de estas mismas poblaciones, utilizando indicadores de diversidad nucletídica y haplotípica de datos publicados por Zhan y otros (2012), y Ghabooli y otros (2013), y que por cierto mostraron una gran heterogeneidad espacial y diversidad genotípica, no se pudieron atribuir las distintas morfologías a los genotipos hallados. En base a este análisis, los autores de los tres trabajos citados sugieren en Paolucci y otros (2014b) que estas variaciones podrían originarse en un proceso de plasticidad fenotípica. Sin embargo, es razonable pensar que más trabajos deberían ser realizados para confirmar o descartar estos hallazgos.
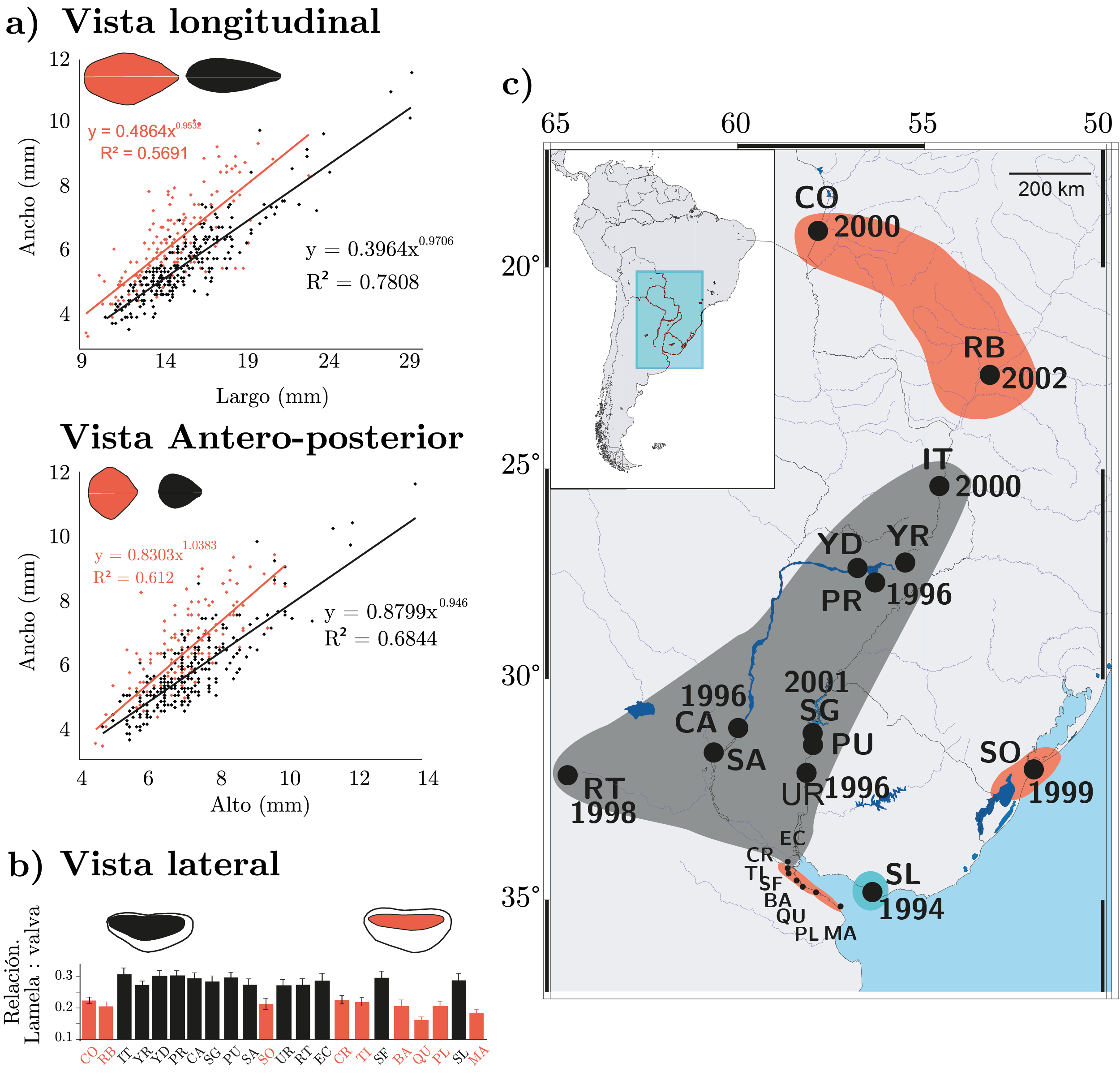
Figura 2. Relaciones ancho-largo, ancho-alto de las valvas (a) y del área branquial relativa (b, modificado de Paolucci et al., 2014b) para ejemplares de Limnoperna fortunei colectados en su área de distribución en Sudamérica (c, modificado de Zhan, et al., 2012).
Las branquias en L. fortunei, así como en bivalvos en general, están típicamente formadas por dos ctenidios de aspecto laminar (Figura 3a), formados a su vez por dos hemibranquias cada uno (Morton, 1973; Jørgensen, 1990). En el caso de L. fortunei, las hemibranquias son desiguales, siendo la hemibranquia externa (la más cercana al manto) más grande dorsoventralmente que la interna (Morton, 2015). Cada hemibranquia está formada por dos lamelas, una ascendente y otra descendente. Las dos lamelas descendentes de cada hemibranquia se juntan dorsalmente, mientras que la unión ventral de las mismas con las respectivas lamelas ascendentes de cada hemibranquia forma los surcos alimentarios marginales (Figura 3a). Estos canales tienen una importancia fundamental en el transporte de partículas y alimento, ya que desembocan en la cavidad oral y en otras estructuras llamadas palpos labiales. Estos últimos son los órganos encargados de seleccionar y separar aquellas partículas sin valor alimenticio y descartarlas en forma de pseudoheces (Jørgensen, 1990). Las poblaciones estudiadas por Paolucci y otros (2014b) mostraron diferencias importantes en el área branquial como respuesta a cambios ambientales, y se presume que estas diferencias podrían también observarse en el área de los palpos labiales (Paolucci, et al., 2014a).
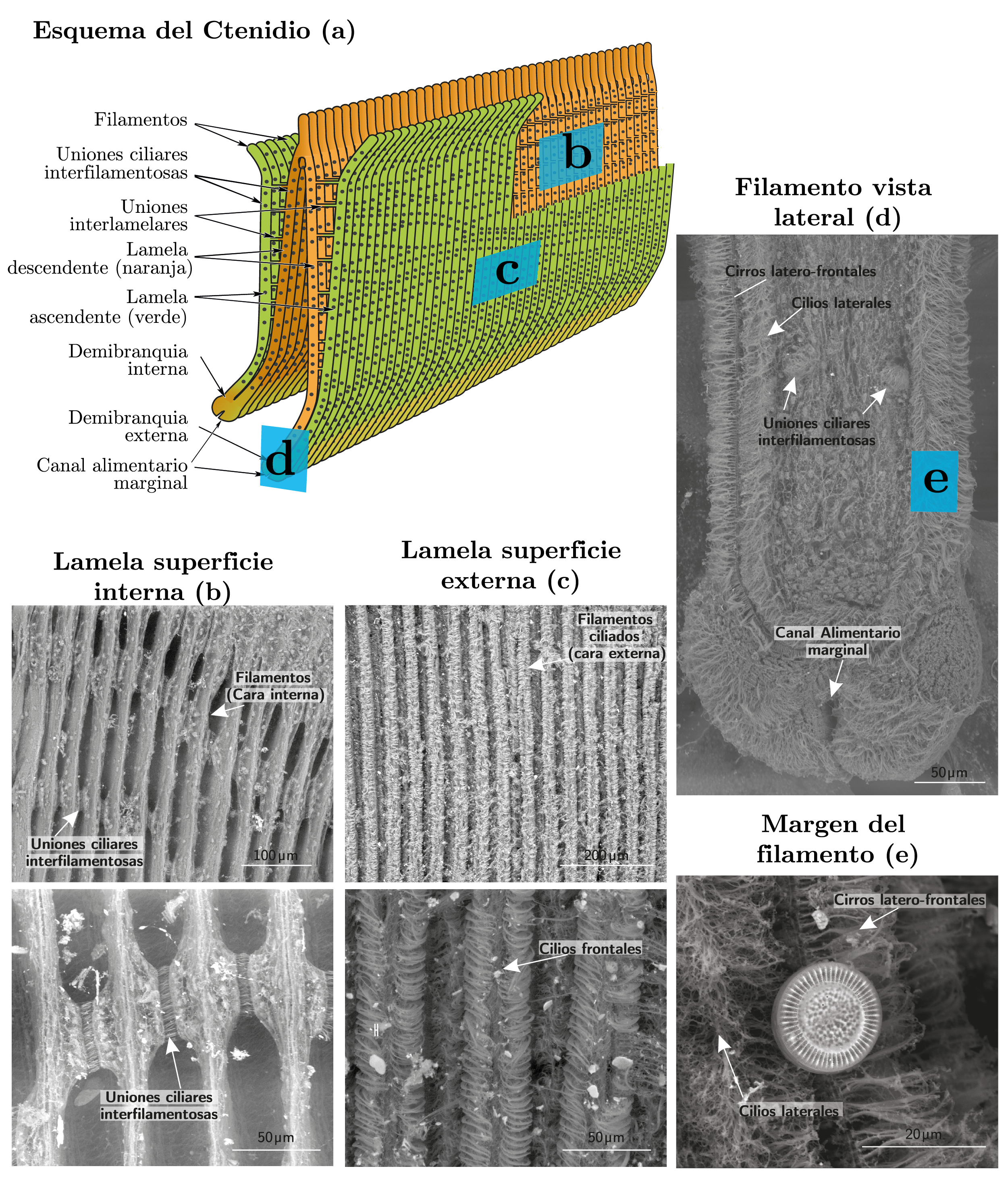
Figura 3. Esquema del ctenidio en Limnoperna fortunei (a, modificado de Morton, 2015), y micrografías electrónicas de la superficie lamelar interna (b), externa (c), vista lateral del filamento (d), y detalle de cilios laterales, cirros latero-frontales con partícula de alimento (e). Fotografías: Esteban M. Paolucci.
Así como en otros lamelibranquios filibranquiados, los ctenidios de L. fortunei están formados por filamentos alineados de manera paralela, con orientación dorso-ventral, y conectados por medio de discos ciliares o uniones ciliares interfilamentosas (Figura 3b-e). Según se comprobó en Dreissena polymorpha, estas uniones entre filamentos son discos ciliares con la capacidad de contraerse o separarse en base a estímulos iónicos ambientales y movimientos musculares, variando hasta en un 25% la superficie de las branquias (Medler y Silverman, 1997; Medler, et al., 1999). En el caso de Limnoperna, la distancia entre las uniones interfilamentosas no presentó diferencias significativas entre las poblaciones estudiadas (Paolucci, et al., 2014b), lo cual probó que las diferencias en el área branquial halladas no corresponden a una reacción espontánea al medio iónico como fue mencionado previamente para D. polymorpha (Medler y Silverman, 1997; Medler, et al., 1999), sino a un proceso ontológico afectado probablemente por las condiciones ambientales.
Las branquias en L. fortunei están formadas por un solo tipo de filamento (branquias homorabdicas), pero cada filamento está cubierto por distintos tipos de cilios, cuyo movimiento conjunto es determinante en las funciones de respiración, alimentación y transporte de partículas. Los filamentos no presentan cilios adfrontales en la superficie interna de la lamela (Figura 3b), pero sí abundantes cilios frontales en la cara externa (lamela superficie externa, Figura 3c), y cilios laterales orientados hacia el espacio entre filamentos adyacentes (Figura 3e). Los cilios laterales (Figura 3e) son responsables de crear las corrientes que desplazan los fluidos a través de los filamentos entre las cámaras infra y supra branquial (definidas por las lamelas), y por consiguiente las corrientes inhalantes y exhalantes (Morton, 2015). Limnoperna también posee un tipo adicional de cilios, presentes también en otros mitílidos, llamados cirros latero-frontales, pues están constituidos por la unión de varios cilios y ubicados entre los cilios laterales y frontales (Figura 3d). Los cirros latero-frontales cumplen la función de filtrado, prolongándose lateralmente desde los filamentos hacia el espacio entre estos y captando las partículas que pasan (Figura 3d-e) para dirigirlas hacia los cilios frontales (Dillon, 2000). Estos últimos transportan dichas partículas hacia los canales orales marginales. A pesar de su importancia funcional, no se observaron diferencias morfológicas tanto para el ancho promedio de los filamentos como para la longitud y densidad promedio de los cilios entre las poblaciones estudiadas en Sudamérica (Paolucci, et al., 2014b).
Los sólidos totales en suspensión y la contaminación fueron reportados previamente, afectando no solo la macroestructura sino también la ultraestructura de las branquias de bivalvos (Gregory, et al., 1999; Beninger, et al., 2008). Una particularidad de los bivalvos filtradores es la secreción de moco, que está aparentemente relacionado a la captación y al transporte de partículas que quedan impregnadas en dicha mucosidad (Jørgensen, 1990), pero también fue observado en gran cantidad en ambientes con mayor contaminación (David y Fontanetti, 2005). En ninguna de las poblaciones de L. fortunei analizadas por Paolucci y otros (2014b) se observaron daños en la estructura branquial, tal como fue reportado previamente para otros organismos filtradores. Sí se observó la presencia de moco en las branquias, y aunque no pudo asociarse inequívocamente a condiciones de alta contaminación o de carga de sedimentos (Figura 4a-b), trabajos experimentales recientes muestran esta reacción característica en L. fortunei ante la presencia de metales pesados (Manske Nunes, et al., 2018).
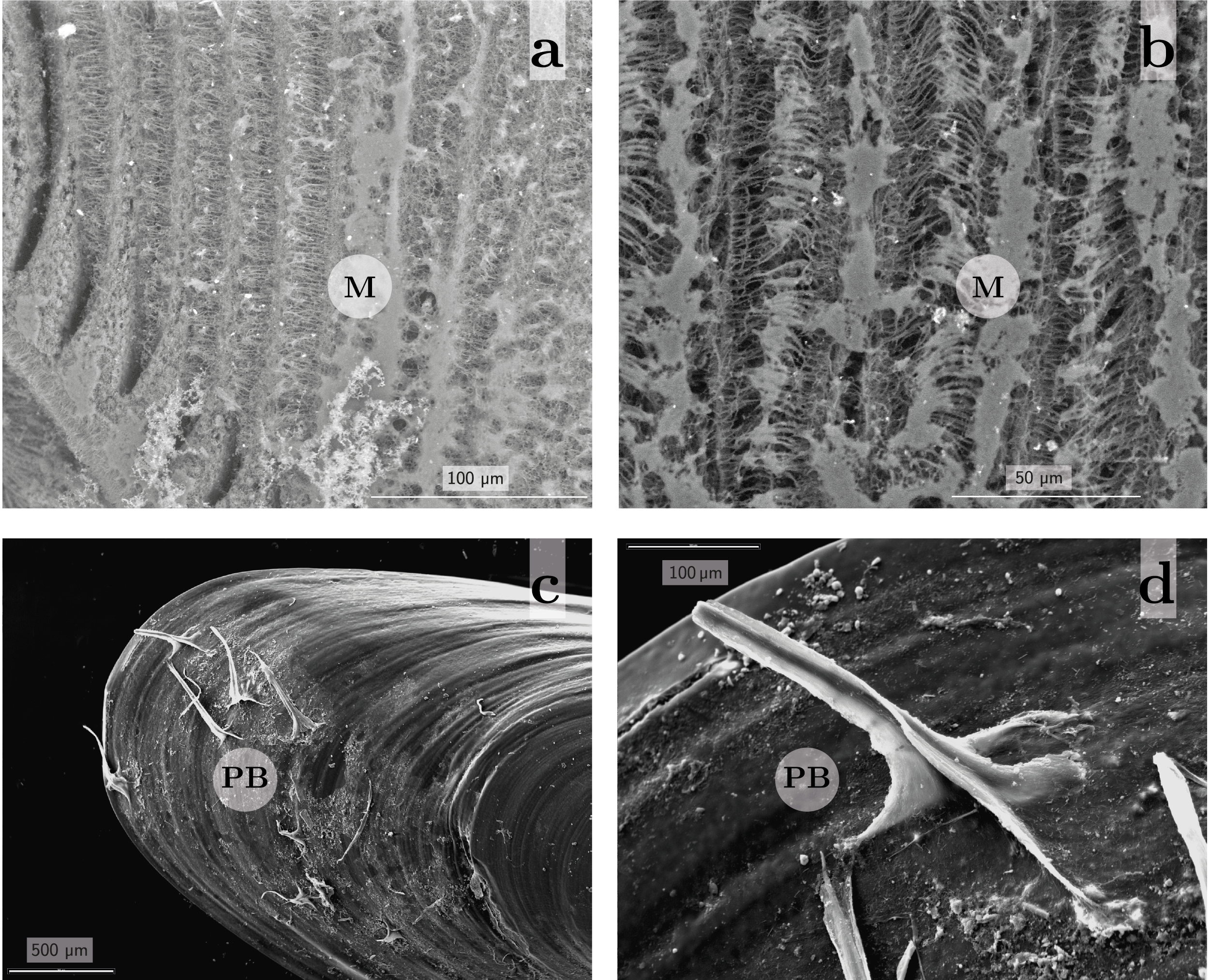
Figura 4. Detalle de la superficie branquial (a-b) secretando moco (M) y presencia de pelos bisales (PB) en el periostraco de Limnoperna fortunei (c-d). Fotografías: Esteban M. Paolucci.
Así como fue observado en otros bivalvos (Ockelmann, 1983; Ockelmann y Dinesen, 2009; Dinesen y Morton, 2014), en L. fortunei se registró otra interesante variación en la morfología externa, que es la presencia de pelos bisales en el periostraco de ejemplares juveniles y adultos (Montalto y Rojas Molina, 2014). Dichos pelos bisales fueron reportados en organismos colectados mayormente en ambientes lénticos del río Paraná, y adheridos a las raíces de macrófitas flotantes. Dado que no se los registró en organismos colectados en ambientes lóticos, se concluyó que las condiciones físicas más rigurosas podrían estar impidiendo el desarrollo de estas estructuras, cuya presencia estuvo inversamente correlacionada con la velocidad de la corriente (Montalto y Rojas Molina, 2014). Estos pelos bisales también fueron observados por el autor de esta revisión en ambientes lóticos, en particular en organismos colectados entre las raíces de árboles a orillas del Canal Arias, en el Delta del Paraná (Figura 4c-d), donde la velocidad de la corriente suele ser más baja que en el curso principal. La mayoría de los autores que investigaron estas estructuras sugiere que su presencia estaría relacionada con una reacción a los depredadores por la aparente utilidad como camuflaje de las mismas (Ockelmann, 1983; Ockelmann y Dinesen, 2009; Dinesen y Morton, 2014).
Variabilidad metabólica en Limnoperna fortunei
Existe una escasa cantidad de trabajos que abordan el estudio de variables fisiológicas y metabólicas de L. fortunei; y la mayoría está enfocada en estudiar la mortalidad y los indicadores metabólicos bajo condiciones extremas. Estos trabajos han medido la capacidad de osmorregulación bajo distintas salinidades (Deaton, et al., 1989); y el nivel de glucógeno en condiciones de inanición, tanto en laboratorio como durante el transporte (Cordeiro, et al., 2016; Cordeiro, et al., 2017) o bajo distintas temperaturas (Andrade, et al., 2018). Si bien todos estos estudios aportan evidencia acerca de un metabolismo flexible capaz de variar en función de variables como la temperatura, la disponibilidad de alimento y las condiciones ambientales en general, pocos aportan evidencia sobre la tasa metabólica en sí misma para esta especie. De hecho, aunque indirectamente, los menores valores de glucógeno observados por Andrade y otros (2018) a 30 ºC en comparación con temperaturas menores indicarían un aumento del metabolismo en general.
En el primer estudio, donde se registraron los valores de consumo de oxígeno y tasa metabólica basal en L. fortunei para una población colectada en el Río de la Plata, Paolucci y otros (2019) reportaron valores promedio que variaron entre 0.89 ± 0.13 y 2.59 ± 0.28 mg O2 gPSLC-1h-1 (PSLC= peso seco libre de cenizas), para temperaturas de entre 17 y 26 ºC. Estos valores fueron muy similares, aunque levemente mayores, a los registrados en poblaciones de su área de distribución natural en China, en la cual la tasa metabólica varió entre 0,84 ± 0,04 y 2,01 ± 0,24 mg O2 gPSLC-1h-1 para temperaturas de entre 15 y 30 ºC (Fang y Xi-hui, 2005). En ambos casos se encontró una relación positiva con la temperatura (efecto Arrhenius) sin caída de la tasa metabólica, demostrando la capacidad de adaptar el metabolismo dentro de este rango de temperaturas.
Discusión y Conclusiones
Aun cuando no se han profundizado los estudios en este campo, resulta evidente que L. fortunei muestra una importante variabilidad morfológica y metabólica en respuesta a las variables ambientales registradas en su área de distribución actual en Sudamérica. Tal como fue observado en otros bivalvos exóticos (Payne, et al., 1995; Drent, et al., 2004; Dutertre, et al., 2009), dichas variaciones pueden verse como una ventaja que permitiría a esta especie sobrevivir y establecerse en los distintos ambientes. Por otro lado, la incapacidad de responder morfológica y metabólicamente ante las variaciones ambientales también nos puede brindar evidencia acerca de los límites en la capacidad de establecerse, explicando la ausencia de esta especie en algunos ambientes. Por supuesto que otros factores también pueden explicar su ausencia en diversos ambientes, como la falta de vectores que permitan la introducción de esta especie; o una vez introducida, distintos factores bióticos o abióticos incompatibles con la supervivencia y reproducción de L. fortunei podrían hacer fracasar el proceso de colonización. Un análisis más profundo de la diversidad de causas y factores que pueden limitar el proceso de invasión para especies exóticas en general puede hallarse en Blackburn y otros (2011).
Los cambios en las proporciones externas observados en L. fortunei (Paolucci, et al., 2014b), con predominio de organismos menos alargados que lo descripto normalmente para la especie (Morton, 1973), podrían responder no solo a altas concentraciones de sólidos totales en suspensión y contaminación sino también a otras condiciones ambientales desfavorables para el crecimiento de esta especie. De manera similar, en otros bivalvos se observaron alteraciones en las proporciones y el crecimiento como respuesta no solo a los sólidos totales en suspensión y la contaminación (Alexander, et al., 1994; Beninger, et al., 2008) sino también a cambios en la densidad poblacional, presión de depredación, tipo de sustrato, disponibilidad de comida y temperatura, entre otros (Marsden, et al., 1996; Sousa, et al., 2007; Peyer, et al., 2010). De hecho, varios de estos autores coinciden al reportar que el impacto de estas variables ambientales en la tasa de crecimiento daría como resultado alteraciones en las proporciones observadas.
Con respecto al efecto de los sólidos totales en suspensión, se ha demostrado experimentalmente el efecto de la carga de sedimentos sobre la capacidad filtradora de L. fortunei (Tokumon, et al., 2015), así como en otros bivalvos (Robinson, et al., 1984; Alexander, et al., 1994; Rosewarne, et al., 2014). En L. fortunei, la actividad filtradora cae un 50% cuando la concentración de sedimentos inorgánicos alcanza 1.0 g l-1, y una caída más importante se produce a concentraciones mayores a 2 g l-1, en comparación con lo observado a 0.1 g l-1 (Tokumon, et al., 2015). Es probable que estas caídas afecten significativamente la capacidad de obtener alimento y oxígeno, con las esperables consecuencias sobre el metabolismo y funcionamiento en general, y expliquen, junto a la presencia de otros posibles efectos, la ausencia de la especie en ambientes con alta carga de sedimentos. En concentraciones menores de sólidos en suspensión, como las observadas en las poblaciones estudiadas en Paolucci y otros (2014b), el mismo mecanismo podría impactar sobre la alimentación y afectar el crecimiento, pero no limitar la posibilidad de supervivencia. De forma similar, altas concentraciones de metales pesados (Cd, Cr, Ni, Cu, Pb, Zn, entre otros), anoxia extrema y otras condiciones propias de cuerpos altamente contaminados resultan letales para L. fortunei (Bálsamo Crespo, et al., 2020; Contardo-Jara, et al., 2009), mientras que niveles aparentemente menores de metales pesados y otros contaminantes producirían un efecto negativo sobre el crecimiento, con cambios en la morfometría (Bonel, et al., 2013) similares a los reportados por Paolucci y otros (2014b).
La disminución del área branquial relativa observada por Paolucci y otros (2014b) en ambientes con mayor carga de sedimentos, podría ser solo una consecuencia indirecta de las distintas tasas de crecimiento y la correspondiente alteración en las proporciones. Sin embargo, podría tener un impacto positivo en la supervivencia si esta menor superficie branquial minimiza la exposición al material en suspensión potencialmente dañino para las estructuras branquiales, como fue observado en otros bivalvos (Payne, et al., 1995; Drent, et al., 2004). De lo contrario, solo disminuiría la superficie de filtración, pudiendo afectar las funciones de alimentación y respiración, sin representar ventaja alguna. Por otro lado, es más probable que el aumento de la superficie de los palpos labiales observado en L. fortunei (Paolucci, et al., 2014a) represente una ventaja en determinados ambientes, dada la importancia de los palpos en la selección de alimento y descarte de material particulado también observado en otros organismos filtradores (Barillé, et al., 2000; Drent, et al., 2004; Dutertre, et al., 2009). Sin embargo, más estudios son necesarios para confirmar si estas variaciones representan una ventaja adaptativa para L. fortunei, tal como fue reportado en otros bivalvos (Drent, et al., 2004); y si en definitiva contribuyen al éxito en el proceso de invasión, como fue sugerido para otras especies de bivalvos invasores (Payne, et al., 1995).
La relación positiva entre tasa metabólica y temperatura ambiental observada en L. fortunei (Paolucci, et al., 2019) evidencia una capacidad metabólica que permite incrementar la tasa metabólica (efecto Arrhenius), aumentando la obtención de energía, utilizada a su vez en otros procesos que también escalan con la temperatura. Estos procesos incluyen tasa de filtración (Sylvester, et al., 2005), desarrollo embrionario (Cataldo, et al., 2005), actividad reproductiva (Boltovskoy, et al., 2009b), crecimiento (Nakano, et al., 2015), y excreción (Fang y Xi-hui, 2005). Consecuentemente, las tasas de respiración y metabólicas variables en función de la temperatura permiten a estos organismos ajustar su metabolismo a fin de obtener la energía requerida para sobrevivir y llevar a cabo los distintos procesos en nuevos ambientes, mientras estén dentro de los límites térmicos de tolerancia. Esta capacidad resulta fundamental para expandir su rango de distribución hacia nuevos hábitats, incluyendo distintos ambientes tropicales y subtropicales de Sudamérica, alcanzando también Centroamérica y Norteamérica, tal como los distintos modelos han predicho (Oliveira, et al., 2015). Sin embargo, estos resultados también evidencian la cercanía del límite de tolerancia térmica de esta especie; especialmente al analizar los datos a 26 ºC y en su comparación con datos obtenidos a 30 ºC, donde los valores de tasa metabólica no aumentan sino que parecen disminuir levemente -cerca de un 25%- para una temperatura mayor (30 ºC). Esto podría ser indicio de una falta de respuesta metabólica a los cambios térmicos dentro de este rango de temperaturas, lo cual fue señalado como un indicio que marca el umbral térmico superior de una especie (Schulte, 2015), o que las poblaciones poseen nichos térmicos diferenciados (Deutsch, et al., 2015).
Es interesante destacar que, aunque se ha estudiado la estructura genética poblacional de esta especie en Sudamérica (Zhan, et al., 2012), y que en comparación con aquellas poblaciones de Asia mostró una relativamente alta diversidad (Ghabooli, et al., 2013), no se halló hasta el momento -como se mencionó previamente- correlación alguna con las variables morfológicas estudiadas como las proporciones ancho-largo o ancho-alto o el área branquial (Paolucci, et al., 2014b). Aunque esto podría depender del tipo de marcador molecular usado, las evidencias sugieren que la variabilidad morfológica observada en estas variables podría ser producto de la plasticidad fenotípica de esta especie. Más estudios son necesarios para confirmar que dicha variabilidad es expresada independientemente del genotipo de los organismos para estas variables (proporciones ancho-largo o ancho-alto y área branquial relativa), y para otras variables morfológicas sobre las que no se ha realizado ningún análisis. Estudios sobre el genoma para esta especie también han dado evidencias de una significativa plasticidad metabólica en respuesta a condiciones extremas (Uliano-Silva,et al., 2015). En particular, se ha reportado una expansión en la cantidad de genes de la familia enzimática HSP70 (Uliano-Silva, et al., 2015), los cuales se han asociado a plasticidad en los límites térmicos para otro bivalvo invasor como Crassostrea gigas (Hamdoun, et al., 2003).
Agradecimientos
A Ernesto Brugnoli Oliveira e Iván González‐Bergonzoni por la invitación a participar en esta publicación. A Demetrio Boltovskoy por su asistencia en la realización de las figuras. A Leila Ron, Sharon Lackie y Fabian Tricarico por la asistencia en la toma de micrografías electrónicas.
