La potenciometría y la conductimetría son los métodos electroanalíticos más comunes en los laboratorios. Una de las ventajas de los métodos electroquímicos es la posibilidad de construir instrumentación no comercial de bajo costo, ya que la interacción física y la respuesta fisicoquímica del sistema son de naturaleza eléctrica. La instrumentación no comercial de bajo costo permite el acceso a los métodos tanto para la investigación como para la enseñanza; además, facilita la adecuación para diseños experimentales o procesos con requerimientos específicos tales como el monitoreo en tiempo real. Varios autores han trabajado en el desarrollo de instrumentación potenciométrica y conductimétrica de bajo costo, implementando sistemas que contemplan desde los electrodos hasta el instrumento de medición. En este trabajo se presenta una revisión sobre los métodos potenciométricos y conductimétricos no comerciales de bajo costo, partiendo de instrumentación muy sencilla hasta circuitos electrónicos más avanzados. Los trabajos que se discuten demuestran que es posible la construcción de instrumentación potenciométrica y conductimétrica con resultados analíticos dentro de los requerimientos establecidos para el análisis químico.
Palabras clave: potenciometría, conductimetría, no comercial.
A potenciometria e a condutimetria são os métodos electroanalíticos mais comuns nos laboratórios. Uma das vantagens dos métodos electroquímicos é a possibilidade de construir instrumentos de baixo custo e não comerciais, uma vez que a interacção física e a resposta físico-química do sistema são de natureza eléctrica. A instrumentação de baixo custo e não comercial permite o acesso aos métodos tanto para a investigação como para o ensino; também facilita a adaptação a desenhos experimentais ou processos com requisitos específicos, tais como a monitorização em tempo real. Vários autores trabalharam no desenvolvimento de instrumentos potenciométricos e condutimétricos de baixo custo, implementando sistemas que vão desde os eléctrodos até ao instrumento de medição. Este documento apresenta uma revisão dos métodos potenciométricos e condutimétricos de baixo custo e não comerciais, desde instrumentação muito simples até circuitos electrónicos mais avançados. Os trabalhos discutidos demonstram que é possível construir instrumentação potenciométrica e condutimétrica com resultados analíticos dentro dos requisitos estabelecidos para a análise química.
Palavras-chave: potenciometria, condutimetria, não comercial.
Introducción
La potenciometría y la conductimetría son los métodos electroanalíticos más comunes en los laboratorios químicos. La potenciometría se basa en medir la diferencia de potencial entre dos electrodos en una celda: uno de referencia y otro indicador sensible y selectivo al analito. El más clásico ejemplo de este método es la medición de pH utilizando un electrodo de membrana de vidrio. El electrodo indicador debe responder a la concentración o, estrictamente, a la actividad de la especie que se determina (Skoog et al., 2017; Shah et al., 2020; Pincus et al., 2021). La determinación electroanalítica potenciométrica está basada en la variación de la diferencia de potencial de una celda en función de la concentración, según la ecuación de Nernst. En este método, el electrodo indicador juega un papel fundamental debido a que la cuantificación depende de la capacidad de reconocimiento selectivo y cuantitativo que este tenga sobre el analito. El desarrollo de electrodos selectivos a iones, moléculas orgánicas y gases es toda un área de investigación dentro de la química analítica (Wang et al., 2021; Elbalkiny y Samir, 2022; Silva et al., 2022; Wadie et al., 2022). Los electrodos selectivos pueden ser de membrana sólida, membrana líquida o membranas especiales (Covington, 1979; Mikhelson, 2013). El instrumento que procesa la señal transducida se llama potenciómetro, el cual se denomina pH-metro específicamente para la medición de pH (Skoog et al., 2017).
La potenciometría es el método electroanalítico por excelencia debido a su sencillez operativa, lo que hace que se requiera de poca especialización para el análisis. Algo contrario a lo que sucede con métodos más potentes, como la voltamperometría, que requieren de conocimientos más especializados en electroquímica. La potenciometría ha permitido la cuantificación de iones como CN−, F−, Cl−, NO3−, I−, Ag+, Hg2+, Cd2+, Pb2+, Ca2+, NH4+ y H+, entre muchos otros (Bakker y Pretsch, 2005; Hein et al., 2020; Isildak y Özbek, 2021); también ha posibilitado la cuantificación de gases disueltos y biomoléculas (Pasierb y Rekas, 2009; Karimi-Maleh et al., 2021). La rapidez de las mediciones, así como la confiabilidad analítica, ha convertido a este método en una herramienta de preferencia en los laboratorios de alta demanda como los industriales o los de servicios científico-técnicos. La elevada selectividad de los electrodos potenciométricos los hace idóneos para muestras complejas, como las de naturaleza biológica, ya que evita los tratamientos de muestra que se requieren para la cuantificación mediante métodos ópticos como la espectrofotometría UV-visible. La potenciometría se usa comúnmente como un método de indicación del punto final de una valoración, lo que se conoce como potenciometría indirecta (Néher-Neumann, 2009).
Por otro lado, la conductimetría se basa en medir la resistencia eléctrica de una disolución o muestra líquida en general al imponer un campo eléctrico alterno entre dos electrodos que se encuentran a una distancia fija (Skoog et al., 2017; Shah et al., 2020). El inverso de la resistencia multiplicado por una constante que refleje las características geométricas de la celda es la conductividad específica de la muestra (McNaught y Wilkinson, 1997; U.S. Geological Survey, 2019). El instrumento que mide la conductividad eléctrica de una muestra líquida se llama conductímetro. Los conductímetros reportan directamente el valor de la conductividad específica. El método emplea un campo eléctrico alterno para evitar la electrólisis de las especies.
La conductimetría es un método limitado en aplicaciones cuantitativas; de manera directa se usa para medir la conductividad eléctrica, la cual puede correlacionarse con la cantidad de sólidos disueltos, pero no con alguna especie o sustancia en particular, a no ser que específicamente en alguna muestra toda la conductividad se deba a alguna sustancia (Thirumalini y Joseph, 2009; Rusydi, 2018). Sin embargo, la conductimetría es un método básico para estudios medioambientales (Das et al., 2006; Bhateria y Jain, 2016), control de procesos (de Souza Antas et al., 2018), control de cultivos agrícolas (Sarabia Meléndez et al., 2011; Cerna-Cueva et al., 2022), estudios en disolución acuosa (Ortega-Hernández et al., 2022) y otros donde la cantidad de sales disueltas debe ser controlada. Al igual que la potenciometría, la conductimetría se utiliza para la indicación del punto final de una valoración; de hecho, la detección conductimétrica es más rápida porque requiere de menos puntos experimentales, arrojando resultados igualmente exactos (Obaya Valdivia et al., 2019).
En general, la principal dificultad para implementar los métodos instrumentales de análisis químico es el costo de la instrumentación. La ventaja de los métodos electroquímicos es que la señal de perturbación sobre el sistema y la señal de respuesta son de naturaleza eléctrica, lo que hace más fácil la construcción de instrumentos no comerciales de bajo costo. Por esto, varios autores se han enfocado en construir este tipo de instrumentación, el cual es más fácil de desarrollar en el caso de los potenciómetros y conductímetros dado que son instrumentos relativamente sencillos (Calero Cáceres y Bonilla, 2011; Jin et al., 2018; Corredor León y Prieto Sáenz, 2019). La construcción de instrumentación de bajo costo permite tener acceso a estos métodos en los casos donde no es posible adquirir la instrumentación comercial; además permite la adecuación a requerimientos específicos de determinados procesos o diseños experimentales, así como la miniaturización del sistema de medida que posibilita la descentralización analítica. En la enseñanza de los métodos electroquímicos, este tipo de instrumentación puede ser particularmente útil ya que es posible el acceso a la actividad docente experimental a muy bajo costo. Las aplicaciones en investigación y control de procesos son igualmente posibles y válidas.
En este trabajo se presenta una revisión de la instrumentación no comercial de bajo costo para el desarrollo de la potenciometría y la conductimetría. Se trata de una forma de contribuir a una investigación y enseñanza más económicas y, por tanto, más accesibles.
Materiales y Métodos
Se realizó una búsqueda y revisión de artículos sobre instrumentación de bajo costo para la implementación de la potenciometría y la conductimetría. Las publicaciones presentadas se extienden desde 2003 hasta 2022. No existe reporte de una revisión sobre el tema analizado, por lo que se pretende mostrar a los investigadores que existen varias opciones para acceder a la instrumentación necesaria para estos métodos, pero a un costo mucho menor que el que se presenta comercialmente.
Resultados y Discusión
Métodos potenciométricos de bajo costo
La instrumentación para el desarrollo de la potenciometría es muy sencilla. Debido a que los electrodos indicadores de membrana presentan una alta resistencia eléctrica, un potenciómetro es básicamente un medidor de voltaje de alta impedancia de entrada (García Torres, 1991). Los parámetros de desempeño analítico de un método potenciométrico tales como la linealidad, selectividad, veracidad y precisión dependen en gran medida del electrodo selectivo (Arada Pérez, 2020); a diferencia de la voltamperometría, donde el potenciostato es clave en los parámetros de desempeño analítico porque dependen de condiciones instrumentales como el tipo de barrido de potenciales, la velocidad de barrido y el tiempo de adquisición de la corriente, entre otras (Skoog et al., 2017). Por esto, las investigaciones en el campo de la potenciometría se han enfocado mayormente en interfases electroquímicas selectivas a especies de interés ambiental, industrial y científico. Con ese objetivo, se han desarrollado diferentes tipos de transductores potenciométricos que se agrupan fundamentalmente en los electrodos de membrana sólida, electrodos de membrana líquida, electrodos de membranas sensibles a gases y electrodos enzimáticos de membrana (Arada Pérez, 2020).
Los electrodos selectivos a ion hidronio (electrodos para pH) se comenzaron a desarrollar a inicios del siglo XX. Posteriormente, los estudios se extendieron a la selectividad para otros iones en disolución, lo que condujo a la introducción del término “electrodo selectivo a ion”, para luego llegar a los electrodos sensibles a gases y a biomoléculas (Arada Pérez, 2020).
La ventaja de los electrodos potenciométricos es que son relativamente sencillos de construir cuando existe algún material capaz de interactuar selectiva y cuantitativamente con la especie química de interés. La interacción es cuantitativa si la respuesta instrumental de diferencia de potencial sigue la ecuación de Nernst. La evaluación de la respuesta a iones interferentes es indispensable en el desarrollo de un electrodo selectivo potenciométrico. Por esto, en la práctica se utiliza la ecuación de Nikolsky, una extensión de la ecuación de Nernst que toma en cuenta las interferencias (Ecuación 1) (Bieg et al., 2017; Arada Pérez, 2020).

Donde:
E es el potencial de la celda potenciométrica (mV).
K es la constante que incluye el potencial estándar del electrodo indicador, el potencial del electrodo de referencia y el potencial de unión líquida (mV).
S es la pendiente referida al cambio decádico de concentración (mV/década).
aA es la actividad del ion principal o primario (mol/L).
aB es la actividad del ion interferente (mol/L).
ZA es la carga del ion principal, incluido el signo.
ZB es la carga del ion interferente, incluido el signo.
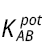 es el coeficiente potenciométrico de selectividad.
es el coeficiente potenciométrico de selectividad.
Varios autores han trabajado en el desarrollo de potenciómetros de bajo costo, llegando algunos a construir adicionalmente electrodos no comerciales. Estos trabajos se discuten a continuación.
Calero Cáceres y Bonilla (2011) presentan el desarrollo de un método micropotenciométrico para la determinación de acidez valorable en bebidas alimentarias. Toda la instrumentación, incluyendo los electrodos, fue de bajo costo y reportada previamente por Baeza (2003a, 2003b). Se construyó una microbureta que consistió en dos jeringas tipo insulina acopladas perpendicularmente (Figura 1). La jeringa horizontal tiene la función de suministrar la disolución valorante a la jeringa principal (vertical). El sistema de agitación fue construido ensamblando un ventilador de computadora en una caja de acrílico con dos terminales eléctricos a los que se conecta una fuente de poder. Este ventilador tiene soldado un imán en su parte superior, el cual queda cubierto por la tapa de la caja de acrílico; esto permite la agitación al introducir en la disolución un imán de agitación común.

Figura 1. Sistema micropotenciométrico de bajo costo usado por Calero Cáceres y Bonilla (2011): 1) Soporte de acrílico, 2) Jeringa tipo insulina, 3) Jeringa para suministrar la disolución valorante a la jeringa tipo insulina, 4) Llave para alternar la entrada de disolución a la jeringa tipo insulina, 5) Tapa de la celda de valoración potenciométrica, 6) Electrodo indicador de pH, 7) Electrodo de referencia, 8) Agitador magnético de bajo costo, 9) Conectores para fuente de poder para el agitador, 10) Ventilador de computadora.
Como electrodo sensible al ion hidronio se utilizó una barra de tungsteno (>99.5 %) soportada en una punta de pipeta. Se evaluaron dos electrodos de referencia, el primero consistió en una barra de cobre sumergida en agua descarbonatada (sistema 1); y el segundo también en una barra de cobre, pero sumergida en una disolución de CuSO4 1 mol/L (sistema 2). Estos sistemas se representan junto con el electrodo indicador en las Ecuaciones 2 y 3. El electrodo de referencia se mantuvo separado de la disolución usando una punta de pipeta con algodón como barrera permeable (Figura 2). Los valores de potencial se midieron con un multímetro comercial de bajo costo.

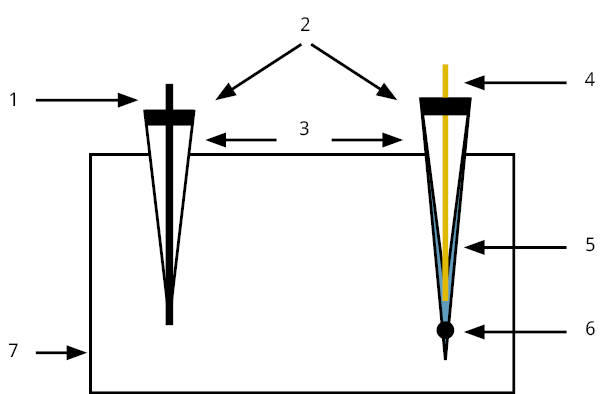
Figura 2. Celda potenciométrica de bajo costo: 1) Barra de tungsteno, 2) Silicona en barra, 3) Puntas de micropipeta, 4) Alambre de cobre, 5) Solución de CuSO4 1 mol/L o agua destilada descarbonatada, 6) Algodón, 7) Vaso de 15 mL. Fuente: Calero Cáceres y Bonilla (2011), reproducida con autorización de los autores.
La validación del método se realizó mediante la determinación de los parámetros de desempeño analítico: límite de detección y cuantificación (LD y LC), exactitud, precisión y sensibilidad. Además, se realizó un estudio comparativo con respecto a la potenciometría comercial con electrodo de membrana de vidrio, analizando la acidez de 30 muestras de jugos y bebidas en un amplio intervalo de concentraciones.
Los resultados mostraron una buena relación lineal entre el potencial medido y el pH de la disolución para ambos sistemas (sistema 1 y sistema 2), con coeficientes de correlación superiores a 0.990. El sistema 1 fue más estable para valores elevados de pH, y el sistema 2 lo fue para valores bajos. En un estudio de estabilidad de cuatro días sin cambiar la solución/agua de los electrodos de referencia, se observó evaporación a partir del tercer día en el electrodo que contenía agua; mientras que en el electrodo de referencia con CuSO4 1 mol/L ocurrió la corrosión del cobre a partir del tercer día y la cristalización en el tapón de algodón a partir del cuarto día. Todo esto provocó que, para los dos sistemas, la sensibilidad solo fuera estable hasta los tres días sin recambio del electrodo de referencia.
Los dos sistemas mostraron buena linealidad del potencial en función del pH. Con el correr de los días, esta relación fue más estable en el sistema 2 que en el sistema 1, lo que indica que la pérdida del agua de llenado del electrodo de referencia del sistema 1 es más significativa que los fenómenos de corrosión y cristalización en el sistema 2. Sin embargo, Calero Cáceres y Bonilla (2011) muestran preferencia por el sistema 1 debido a que para la renovación del electrodo de referencia del sistema 2 se requiere la preparación de una nueva solución de CuSO4 1 mol/L y la sustitución del alambre de cobre, mientras que en sistema 1 solo es necesario sustituir el agua y la barrera permeable de algodón, acompañado de un lijado del contacto del alambre de cobre con el multímetro. El método micropotenciométrico fue preciso, demostrado estadísticamente mediante una prueba t para 9 repeticiones a diferentes niveles de acidez desde el 0.1 % hasta el 10 %. El LD fue del 0.02 % y el LC fue del 0.03 %. El método fue exacto, con coeficientes de variación entre el 1.5 % y el 6.54 %; así como una recuperación sobre analito añadido del 100 % al 107 %. Finalmente, los investigadores realizaron la determinación de acidez en tres bebidas mediante valoración ácido-base con la instrumentación de bajo costo y con instrumentación comercial a escala convencional usando un electrodo de membrana de vidrio para pH. Se observó una elevada correlación entre los valores cuantificados por ambos métodos para un rango de acidez muy amplio.
El trabajo de Calero Cáceres y Bonilla (2011) es particularmente interesante, puesto que es de las pocas investigaciones que realiza una amplia validación analítica de un método potenciométrico de bajo costo que contempla desde el transductor electroquímico (electrodos) hasta los materiales volumétricos y el equipo de agitación magnética. Los resultados demuestran que la instrumentación propuesta es competitiva con el método comercial a escala convencional.
Papadopoulos y Jannakoudakis (2016) muestran la construcción de un pH-metro basado en un microcontrolador y amplificadores operacionales. El desarrollo está focalizado en una actividad de aprendizaje para alumnos, por lo que los autores hacen énfasis en aspectos básicos de la electrónica de este tipo de sistemas, algo que puede ser útil para principiantes en la construcción de instrumentación potenciométrica. Los amplificadores operacionales son de marcada importancia para los sistemas de adquisición de datos sobre celdas electroquímicas ya que permiten la amplificación, la amortiguación, el filtrado y otras funciones que hacen posible la digitalización de la señal de salida desde un sensor electrométrico. Por su parte, los microcontroladores permiten el procesamiento de los datos, la transferencia hacia un aparato de cómputo y la visualización de la información.
Los investigadores utilizaron una placa de desarrollo de bajo costo marca Tiva (Texas Instruments). Un convertidor analógico-digital (ADC) permitió la adquisición de señal desde el sensor hasta el microcontrolador. La programación se realizó en el entorno de desarrollo integrado Code Composer Studio (CCS Team, 2016). El procesamiento de la señal analógica fue posible usando ASLK PRO (ASLK PRO Team, 2016). El diseño del circuito analógico se realizó con el entorno de simulación Tina (TINA Team, 2016). Los datos adquiridos por el ADC se almacenan en una memoria y luego pueden ser mostrados en una pantalla o transferidos a la PC; la comunicación con esta última se consiguió con un terminal RS-232. Los autores muestran una interfaz gráfica sencilla e intuitiva que permite la manipulación del instrumento y la visualización de los valores de medición de pH empleando un electrodo comercial de membrana de vidrio. Este trabajo es una excelente guía para la construcción de un pH-metro de bajo costo con prestaciones comparables a las de los instrumentos comerciales.
Jin et al. (2018) muestran la construcción de un potenciómetro inalámbrico de bajo costo y de código abierto. Los autores mencionan que en un sistema potenciométrico de dos electrodos existe una alta impedancia en el rango de 10 MΩ y 4 GΩ. Esto exige el uso de instrumentos de medición con una alta impedancia de entrada de aproximadamente 1012 Ω o una corriente de polarización de entrada del orden de pA. Es importante el análisis de ecuaciones fisicoquímicas, a partir de la ecuación de Nernst, que realizan Jin et al. (2018) para llegar a la ecuación que explica la medición de pH mediante un sistema potenciométrico con un electrodo indicador de pH y un electrodo de referencia. El desarrollo de ecuaciones depende del sistema galvánico, es decir, de las reacciones de media celda en el electrodo indicador y en el de referencia. Los autores usaron dos electrodos sensibles a pH, uno de membrana de vidrio y otro de Pd/PdO; el electrodo de referencia fue de Ag/AgCl. La expresión matemática para la determinación potenciométrica de pH se muestra en la Ecuación 4.
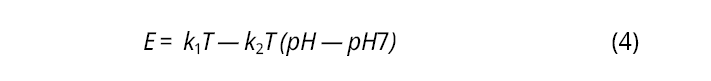
Donde:
E es el potencial galvánico medido entre el electrodo indicador y el de referencia (mV).
k1 es el coeficiente de calibración a pH 7 (mV/K).
k2 es el coeficiente de calibración para medio ácido o básico (mV/pH-K).
T es la temperatura (K).
Los coeficientes de calibración se extraen de los datos generados en las mediciones sobre los buffer ácido o básico y de pH 7.
El instrumento propuesto por Jin et al. (2018) utiliza un microcontrolador Arduino Nano, un buffer electrónico para medir el potencial galvánico en el electrodo de pH, un buffer para ajustar el potencial del electrodo de referencia de Ag/AgCl, dos filtros pasa-bajo, un módulo ADC para convertir la señal analógica de voltaje a una digital y un módulo de Bluetooth para la conexión inalámbrica. Los autores destacan que la conexión inalámbrica del instrumento tiene dos ventajas: una radica en que la adquisición inalámbrica de datos puede eliminar el ruido de la alimentación eléctrica, el cual afecta la precisión del voltaje medido, y la otra ventaja es que abre la posibilidad del control remoto del instrumento usando un smartphone.
El software para controlar el instrumento y visualizar los resultados se desarrolló en Python. Se construyó una interfaz gráfica para la manipulación de los parámetros y la visualización de las mediciones. Por ejemplo, con la interfaz es posible seleccionar si la comunicación se realizará mediante USB o mediante Bluetooth. La Ecuación 4 indica la dependencia del potencial galvánico con la temperatura, algo tomado en cuenta por Jin et al. (2018), quienes introdujeron un sistema de compensación del pH. El instrumento tiene una elevada frecuencia de muestreo de temperatura y pH, así como de actualización de los datos mostrados al usuario. En la validación de la instrumentación se utilizó una fuente de energía de corriente directa para simular el voltaje de salida desde el electrodo de pH. Se utilizó un multímetro como instrumento de referencia sobre el voltaje impuesto desde la fuente de poder. El voltaje impuesto fue barrido desde 100 hasta 3200 mV en pasos de 100 mV, colectando 20 muestreos para cada voltaje impuesto. Una gráfica de la diferencia del voltaje medido y el impuesto contra el voltaje impuesto mostró poca diferencia entre los valores medidos con el instrumento y con el voltímetro de referencia, demostrando que la medición es exacta.
A partir de aquí, se estudió la respuesta de los electrodos mediante dos ciclos reversibles de pH 4-7-10-7-4. El electrodo de Pd/PdO mostró mayor sensibilidad (65.3 ± 0.2 mV/pH vs. 57.8 ± 0.9 mV/pH para el de vidrio), mejor respuesta (15 s vs. 75 s para el de vidrio) y mayor precisión (± 0.003 pH vs. ± 0.015 pH para el de vidrio). Sin embargo, el electrodo de vidrio mostró mejor reversibilidad. Este trabajo propone un instrumento potenciométrico de bajo costo y de fácil construcción, y muestra la posibilidad de utilizar dos tipos de electrodos de pH, brindando oportunidades de desarrollo no comercial tanto del instrumento como del propio transductor electroquímico.
Zambrano Sánchez et al. (2019) muestran el diseño y la construcción de un instrumento que permite el monitoreo de pH en procesos agrícolas. El equipo supone una disminución de costos del 50 % con respecto a la instrumentación comercial utilizada para la comparación de las mediciones. El dispositivo fue construido en tres módulos: (1) alimentación, (2) procesamiento y (3) visualización. El primer módulo se ocupa de brindar la energía eléctrica necesaria para el funcionamiento del aparato mediante una batería recargable de litio. El sistema de alimentación implementado permite la utilización del instrumento mientras se carga mediante un circuito de carga compartida. El segundo módulo se encarga de captar y adecuar la señal del sensor de pH para ser procesada por un microcontrolador. El tercero se encarga de mostrar los resultados de la medición en tiempo real. El electrodo es un sensor de pH comercial de encapsulamiento metálico, el cual es más adecuado para mediciones en suelos. El circuito de medición está basado en amplificadores operacionales y a través del microcontrolador se consigue la visualización de los resultados en una pantalla LCD 16x2. El programa para el microcontrolador fue desarrollado en lenguaje C.
Los investigadores inicialmente realizaron simulaciones para voltajes correspondientes a una diferencia de potencial en medio ácido, neutro y básico, a fin de comprobar el diseño de cada uno de los módulos del instrumento. A partir de aquí realizaron mediciones reales de pH. En una primera muestra, los resultados de 4 mediciones en el tiempo mostraron desviaciones con respecto al instrumento comercial entre el 18.70 % y el 26.85 %, siendo la desviación promedio del 24.02 %. Por ejemplo, para una medición de pH de 5.61 usando el pH-metro comercial, el instrumento de bajo costo midió 7.67, siendo una importante diferencia en términos analíticos. En otra muestra, también para 4 mediciones en el tiempo, se obtuvieron menores desviaciones entre el 6.32 % y el 13.50 % , y un promedio de 8.83 %. Los autores atribuyen estas desviaciones al hecho de que las mediciones se realizaron en muestras húmedas, algo distinto a la utilidad con la que se concibió el instrumento de medición. Finalmente, llevaron a cabo mediciones de pH en muestras de suelo. En general, se observó que el instrumento presenta importantes desviaciones con respecto al instrumento comercial a valores de pH ácidos, por lo que los autores establecieron un rango de trabajo para el pH-metro de bajo costo entre 4 y 8, destacando que los valores de pH de un suelo de siembra suelen encontrarse entre 5 y 7, lo que hace útil al instrumento para la finalidad que se concibió.
Ozer et al. (2022) muestran un prototipo de bajo costo para la detección potenciométrica de iones Na+ y K+ mediante electrodos selectivos impresos 3D. Para la fabricación de los electrodos selectivos, una capa intermedia de negro de humo y una membrana selectiva a iones se depositaron mediante drop-casting robotizado en la superficie de un electrodo de plantilla impresa de carbono. Según los autores, el uso del robot mejora la robustez de los electrodos y disminuye el tiempo de modificación. Para las mediciones potenciométricas se desarrolló un potenciómetro inalámbrico de bajo costo (menos de 25 dólares) controlado mediante smartphone. La respuesta de los electrodos mostró una pendiente nernstiana de 58.2 ± 2.6 mV/década para iones sodio y 56.1 ± 0.7 mV/década para iones potasio. El límite de detección del sistema desarrollado fue de 10-5 mol/L. Se realizaron aplicaciones de la instrumentación en muestras de orina y en muestras artificiales de sudor a concentraciones clínicas.
Métodos conductimétricos de bajo costo
La construcción de un conductímetro puede ser sencilla ya que es posible utilizar un clásico puente de Wheatstone (Figura 3), el cual es un circuito que consta de cuatro resistores: dos de resistencia conocida, uno de resistencia variable y uno de resistencia desconocida. Esta última sería la de la muestra analizada.
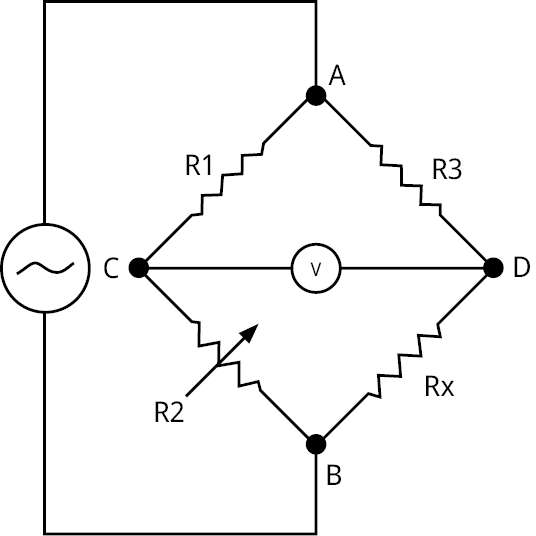
Figura 3. Puente de Wheatstone de cuatro resistencias con fuente de corriente alterna.
Una relación entre resistencias permite hallar el valor de la resistencia desconocida (Ecuación 5). La resistencia variable se usa para establecer el equilibrio entre las corrientes que circulan en el puente, de modo que cuando se mide un voltaje nulo entre los puntos C y D el valor de la resistencia variable es igual al de la resistencia desconocida (muestra analizada).
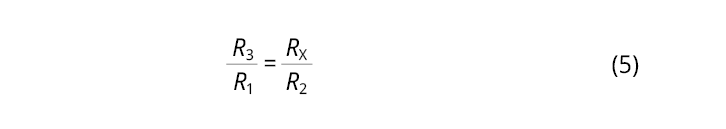
La conductancia específica, o conductividad eléctrica de la muestra, se calcula a partir de la resistencia mediante la Ecuación 6. L/A se conoce como constante de la celda, puesto que es una relación que debe permanecer invariable entre la calibración y las mediciones en la muestra. Esto se consigue manteniendo los electrodos conductimétricos en una posición fija.

Donde:
K es la conductancia específica (S/cm, s = Ω-1).
R es la resistencia medida (Ω).
L es la distancia entre los electrodos (cm).
A es el área transversal entre los electrodos (cm2).
Los dispositivos modernos de medición de conductividad eléctrica se basan en circuitos que emplean amplificadores operacionales, microcontroladores y otros componentes. Algunos de estos circuitos pueden estar basados en el puente de Wheatstone (Rajendran y Neelamegam, 2004) y otros no (Skoog et al., 2017), pero en general la señal eléctrica medida es la resistencia, y la conductividad eléctrica se puede calcular mediante la Ecuación 6.
López-Cerdeña et al. (2005) muestran la realización de valoraciones microconductimétricas de HCl con NaOH empleando instrumentación no comercial de bajo costo. Para las valoraciones se usaron microelectrodos de acero inoxidable acoplados de manera fija a una celda de 5 mL. Se siguió la resistencia de la celda con cada adición de agente valorante. Como hemos descrito, la resistencia de la disolución está relacionada con la conductividad. Durante una valoración conductimétrica, según va transcurriendo la reacción de neutralización por las sucesivas adiciones de valorante, la conductividad total de la disolución debe disminuir debido a que la cantidad de iones presentes es menor, lo cual es instrumentalmente medible como un aumento de la resistencia de la disolución (Figura 4).
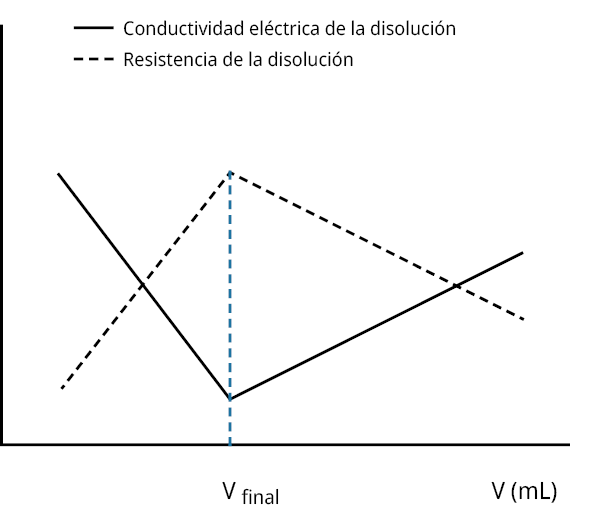
Figura 4. Variación de la conductividad eléctrica y la resistencia de una disolución durante una valoración conductimétrica ácido-base.
Después del punto de equivalencia, la resistencia debe disminuir nuevamente debido a que con cada adición de valorante en exceso hay mayor cantidad de iones presentes en la disolución. Los autores mencionan que la técnica microconductimétrica se aplicó también para muestras de aspirina, naproxeno y alcaloides de tabaco en medio acético. Los resultados obtenidos fueron comparados con determinaciones usando instrumentación comercial y no se observaron diferencias significativas.
Nasser y Hamoudeh (2020) presentan la fabricación de una celda conductimétrica usando dos electrodos de acero inoxidable 316 de dimensiones 1x4 cm y un grosor de 0.5 mm; estos se acoplaron en una celda metálica separados a una distancia fija de 1 cm. Los electrodos se conectaron a un puente de Wheatstone de cuatro resistores, dos de 5 kΩ y uno de resistencia variable. El cuarto resistor del puente fue el par de electrodos inmersos en la disolución analizada. El puente se conectó a un transformador de corriente alterna para suministrar la señal a los electrodos. El cálculo de la resistencia de la disolución se realizó según la relación entre resistencias de un puente de Wheatstone. Los autores calcularon dos coeficientes de corrección de la conductividad con la temperatura, usando como temperatura de referencia los 25 ℃. A partir de estos valores se realizó la calibración con disoluciones de KCl de concentraciones 0.1 mol/L, 0.01 mol/L y 0.001 mol/L; logrando un coeficiente de correlación de 0.9999 entre la conductividad y la concentración del electrolito. La celda conductimétrica construida fue aplicada a la medición directa de conductividad en una disolución de NaCl con una calibración previa para diferentes concentraciones de esta sal. Los resultados fueron comparables a los obtenidos con un aparato comercial. También se realizaron valoraciones conductimétricas de HCl con NaOH, y de AgNO3 con KCl. En todas las valoraciones se obtuvieron resultados consistentes con los obtenidos usando un aparato comercial para la indicación conductimétrica. Este estudio es un claro ejemplo de cómo la instrumentación conductimétrica sencilla permite arrojar resultados confiables y significativamente comparables a los obtenidos con un instrumento comercial.
Con un circuito más avanzado que los anteriores, Wurm et al. (2019) presentan la construcción de un instrumento para el monitoreo en tiempo real de la conductividad eléctrica en la solución de nutrientes de cultivos hidropónicos. El monitoreo de la conductividad permite mantener los sistemas hidropónicos en las condiciones óptimas de salinidad. Para la construcción del conductímetro se integró un circuito electrónico a una placa Arduino Mega. Los electrodos fueron de carbono, construidos con escobillas de motores monofásicos, siendo más estables que los electrodos de acero inoxidable y más baratos que los electrodos comerciales de platino platinizado. El instrumento se alimenta con 9 V; un circuito con un regulador LM317 establece una tensión de referencia de 4.5 V que permite las etapas de adaptación de impedancia, amplificación y rectificación con amplificadores operacionales. La señal alterna impuesta sobre los electrodos conductimétricos tiene una frecuencia de 730 Hz, la cual se genera en la placa Arduino. La señal de respuesta de los electrodos es amplificada, rectificada y transformada en una señal continua mediante un filtro pasa-bajos. Este tipo de filtros atenúa las frecuencias más altas de una señal, permitiendo el paso solamente de bajas frecuencias. El voltaje de esta señal continua está relacionado cuantitativamente con la conductividad de la disolución. El desarrollo de una aplicación permitió el monitoreo y la visualización gráfica de los datos de conductividad en tiempo real. Este trabajo es muy interesante, y es un ejemplo de las potencialidades que pueden brindar los métodos electroanalíticos de bajo costo cuando se desarrollan enfocados en una necesidad científica o tecnológica específica. En este caso, se integraron conocimientos de electroquímica con conocimientos de electrónica y desarrollo de software para lograr el monitoreo en tiempo real de un parámetro de control en sistemas hidropónicos.
Conclusiones
Es posible construir instrumentación de bajo costo para la implementación de la potenciometría y la conductimetría. Se pueden crear instrumentos muy sencillos basados en circuitos eléctricos, y más sofisticados basados en circuitos electrónicos con amplificadores operacionales, microcontroladores y otros componentes que permiten el control mediante computadora. Los instrumentos no comerciales arrojan resultados comparables a los que se obtienen con la instrumentación comercial, la cual es más costosa. La construcción de instrumentos también permite la adecuación de los métodos para procesos tecnológicos o diseños experimentales de requerimientos específicos. En general, la instrumentación potenciométrica y conductimétrica de bajo costo se traduce en una mayor accesibilidad para la investigación en laboratorios químicos y la enseñanza de estos métodos en lugares de adquisición limitada.
Agradecimientos
Los autores agradecen al Ing. Luis Eduardo González Abreu por la asesoría en los aspectos relacionados con la programación de software y los entornos integrados de desarrollo.
Referencias
Arada Pérez, M. A., 2020. Sensores potenciométricos. Ejemplos prácticos. Santiago de Cuba: Ediciones UO. ISBN: 978-959-207-672-3.
ASLK PRO Team, 2016. Analog System Lab Kit PRO University Kit [En línea]. Texas: Texas Instruments Incorporated. [Consulta: febrero de 2023]. Disponible en: http://www.ti.com/tool/aslkpro
Baeza, A., 2003a. Microbureta a microescala total para titulometría. En: Rev. Chil. Educ. Cient., 1(2), pp. 4-7.
Baeza, A., 2003b. Titulaciones ácido-base potenciométricas a microescala total con microsensores de pH y de referencia de bajo costo. En: Rev. Chil. Educ. Cient., 1(2), pp. 16-19.
Bakker, E. y Pretsch, E., 2005. Potentiometric sensors for trace-level analysis. En: Trends Anal. Chem., 24(3), pp.199-207. DOI: https://doi.org/10.1016/j.trac.2005.01.003
Bhateria, R. y Jain, D., 2016. Water quality assessment of lake water: a review. En: Sustain. Water Resour. Manag., 2, pp.61-173. DOI: https://doi.org/10.1007/s40899-015-0014-7
Bieg, C.; Fuchsberger, K. y Stelzle, M., 2017. Introduction to polymer-based solid-contact ion-selective electrodes—basic concepts, practical considerations, and current research topics. En: Anal. Bioanal. Chem., 409, pp.45–61. DOI: https://doi.org/10.1007/s00216-016-9945-6
Calero Cáceres, W. y Bonilla, P., 2011. Desarrollo de un método micropotenciométrico de bajo costo para la determinación de acidez valorable. En: Química Central, 2(1), pp.3-12.
CCS Team, 2016. Code Composer Studio (CCS) Integrated Development Environment (IDE) [En línea]. Texas: Texas Instruments Incorporated. [Consulta: febrero de 2023]. Disponible en: http://www.ti.com/tool/ccstudio
Cerna-Cueva, A. F.; Aguirre-Escalante, C.; Wong-Figueroa, B. L.; Tello-Cornejo, J. L. y Pinchi-Ramírez, W., 2022. Calidad de agua para riego en la cuenca Huallaga, Perú. En: Sci. Agric., 13(3), pp.239-248. DOI: https://doi.org/10.17268/sci.agropecu.2022.022
Corredor León, B. y Prieto Sáenz, A., 2019. Diseño y construcción de un dispositivo para determinar las cualidades del agua. En: Letras ConCiencia TecnoLógica, 15, pp.8-12. DOI: https://doi.org/10.55411/26652544.154
Covington, A. K., 1979. Ion-selective electrode methodology. Volume 1. Florida: CRC Press. ISBN: 1315894785
Das, R.; Samal, N. R.; Roy, P. K. y Mitra, D., 2006. Role of electrical conductivity as an indicator of pollution in shallow lakes. En: Asian J. Water Environ. Pollut., 3(1), pp.143-146.
de Souza Antas, F. P.; da Silva Dias, N.; Moreira de Oliveira, A.; Nogueira de Sousa Neto, O.; dos Santos Fernandes, C.; de Oliveira Miranda, N.; de Sousa Gurgel, G. C.; de Sousa Junior, F. S.; de Oliveira Lima, A. y Ferreira Neto, M., 2018. Hydrochemical characterization of water resources from reverse osmosis desalination plants. En: J. Agric. Sci., 10(12), pp.445-457. DOI: https://doi.org/10.5539/jas.v10n12p445
Elbalkiny, H. T. y Samir, A., 2022. Green potentiometric electrode for determination of salbutamol in biological samples. En: Anal. Biochem., 659, 114949. DOI: https://doi.org/10.1016/j.ab.2022.114949
García Torres, A., 1991. Medidor de pH de bajo costo. En: Educ. Quím., 2(2), pp.81-85. DOI: https://doi.org/10.22201/fq.18708404e.1991.2.66957
Hein, R.; Beer, P. D. y Davis, J. J., 2020. Electrochemical anion sensing: supramolecular approaches. En: Chem. Rev., 120(3), pp.1888-1935. DOI: https://doi.org/10.1021/acs.chemrev.9b00624
Isildak, Ö. y Özbek, O., 2021. Application of potentiometric sensors in real samples. En: Crit. Rev. Anal. Chem., 51(3), pp.218-231. DOI: https://doi.org/10.1080/10408347.2019.1711013
Jin, H.; Qin, Y.; Pan, S.; Alam, A. U.; Dong, S.; Ghosh, R. y Deen, M. J., 2018. Open-source low-cost wireless potentiometric instrument for pH determination experiments. En: J. Chem. Educ., 95(2), pp.326-330. DOI: https://doi.org/10.1021/acs.jchemed.7b00479
Karimi-Maleh, H.; Orooji, Y.; Karimi, F.; Alizadeh, M.; Baghayeri, M.; Rouhi, J.; Tajik, S.; Beitollahi, H.; Agarwal, S.; Gupta, V. K.; Rajendran, S.; Ayati, A.; Fu, Li.; Sanati, A. L.; Tanhaei, B.; Sen, F.; Shabani-nooshabadi, M.; Asrami, P. N. y Al-Othman, A., 2021. A critical review on the use of potentiometric based biosensors for biomarkers detection. En: Biosens. Bioelectron., 184, 113252. DOI: https://doi.org/10.1016/j.bios.2021.113252
López-Cerdeña, K.; García-Mendoza, A.; de Santiago, A. y Baeza, A., 2005. Química analítica a microescala total: microconductimetria. En: Rev. Cub. de Quím., 17, pp.346.
McNaught, A. D. y Wilkinson A., eds., 1997. IUPAC compendium of chemical terminology. Oxford: Blackwell Scientific Publications. ISBN 0-9678550-9-8. DOI: https://doi.org/10.1351/goldbook
Mikhelson, K. N., 2013. Ion-selective electrodes. Berlín: Springer Dordrecht. ISBN: 978-3-642-36886-8. DOI: https://doi.org/10.1007/978-3-642-36886-8
Nasser, H. N. y Hamoudeh, D. H., 2020. Manufacture of an electrical conductor cell of chromium 316 and its analytical applications. En: Chemisty Research Journal, 5(1), pp.126-136.
Néher-Neumann, E., 2009. Advanced potentiometry. Potentiometric titrations and their systematic errors. Berlín: Springer Dordrecht. ISBN: 978-1-4020-9525-2. DOI: https://doi.org/10.1007/978-1-4020-9525-2
Obaya Valdivia, A. E.; Montaño-Osorio, C. y Vargas-Rodríguez, Y. M., 2019. Conductometric Titration of Metformin Hydrochloride: Simulation and Experimentation. En: J. Chem. Chem. Eng., 13, pp.105-111. DOI: https://doi.org/10.17265/1934-7375/2019.03.003
Ortega-Hernández, N.; Ortega-Romero, M.; Medeiros-Domingo, M.; Barbier, O. C. y Rojas-López, M., 2022. Detection of biomarkers associated with acute kidney injury by a gold nanoparticle based colloidal nano-immunosensor by fourier-transform infrared spectroscopy with principal component analysis. En: Anal. Lett., 55(15), pp.2370-2381. DOI: https://doi.org/10.1080/00032719.2022.2053982
Ozer, T.; Agir, I. y Henry, C. S., 2022. Rapid prototyping of ion-selective electrodes using a low-cost 3D printed internet-of-things (IoT) controlled robot. En: Talanta, 247, 123544. DOI: https://doi.org/10.1016/j.talanta.2022.123544
Papadopoulos, N. J. y Jannakoudakis, A., 2016. A chemical instrumentation course on microcontrollers and op amps. Construction of a pH meter. En: J. Chem. Educ., 93(7), pp.1323-1325. DOI: https://doi.org/10.1021/acs.jchemed.5b00743
Pasierb, P. y Rekas, M., 2009. Solid-state potentiometric gas sensors—current status and future trends. En: J. Solid State Electrochem., 13, pp.3-25. DOI: https://doi.org/10.1007/s10008-008-0556-9
Pincus, M. R.; Lifshitz, M. S. y Bock, J. L., 2021. Analysis: principles of instrumentation. En: McPherson, Richard y Pincus, Matthew. Henry’s clinical diagnosis and management by laboratory methods. Amsterdam: Elsevier. pp.35-59. ISBN: 9780323755085
Rajendran, A. y Neelamegam, P., 2004. Design and development of microcontroller-based conductivity measurement system. En: Indian J. Pure Appl. Phys., 42, pp.182-188.
Rusydi, A. F., 2018. Correlation between conductivity and total dissolved solid in various type of water: A review. En: IOP Conf. Ser.: Earth Environ. Sci., 118, 012019. DOI: https://doi.org/10.1088/1755-1315/118/1/012019
Sarabia Meléndez, I. F.; Cisneros Almazán, R.; Aceves De Alba, J.; Martín Durán García, H. M. y Castro Larragoitia, J., 2011. Calidad del agua de riego en suelos agrícolas y cultivos del Valle de San Luis Potosí, México. En: Rev. Int. Contam. Ambient, 27(2), pp.103-113.
Shah, N.; Arain, M. B. y Soylak, M., 2020. Historical background: milestones in the field of development of analytical instrumentation. En: New Generation Green Solvents for Separation and Preconcentration of Organic and Inorganic Species. Amsterdam: Elsevier, pp.45-73. ISBN: 9780128185698. DOI: https://doi.org/10.1016/B978-0-12-818569-8.00002-4
Silva, R.; Zhao, K.; Ding, R.; Chan, W. P.; Yang, M.; Yip, J. S. Q. y Lisak, G., 2022. Ion-selective membrane modified microfluidic paper-based solution sampling substrates for potentiometric heavy metal detection. En: Analyst, 147(20), pp.4500-4509. DOI: https://doi.org/10.1039/D2AN01108E
Skoog, D. A.; Holler, F. J. y Crouch, S. R., 2017. Principles of Instrumental Analysis. 7ma Ed. Boston: Cengage Learning. ISBN: 978-1-305-57721-3.
Thirumalini, S. y Joseph, K., 2009. Correlation between electrical conductivity and total dissolved solids in natural waters. En: Malaysian J. Sci., 28(1), pp.55-61. DOI: https://doi.org/10.22452/mjs.vol28no1.7
TINA Team, 2016. TINA-TI SPICE-Based Analog Simulation Program [En línea]. Texas: Texas Instruments Incorporated. [Consulta: febrero de 2023]. Disponible en: http://www.ti.com/tool/tina-ti
U.S. Geological Survey, 2019. Chapter A6.3. Specific Conductance. En: U.S. Geological Survey. U.S. Geological Survey techniques and methods. Reston: USGS. ISSN: 2328-7055. DOI: https://doi.org/10.3133/tm9A6.3
Wadie, M.; Marzouk, H. M.; Rezk, M. R.; Abdel-Moety, E. M. y Tantawy, M. A., 2022. A sensing platform of molecular imprinted polymer-based polyaniline/carbon paste electrodes for simultaneous potentiometric determination of alfuzosin and solifenacin in binary co-formulation and spiked plasma. En: Anal. Chim. Acta, 1200, 339599. DOI: https://doi.org/10.1016/j.aca.2022.339599
Wang, C.; Qi, L. y Liang, R., 2021. A molecularly imprinted polymer-based potentiometric sensor based on covalent recognition for the determination of dopamine. En: Anal. Methods, 13(5), pp.620-625. DOI: https://doi.org/10.1039/D0AY02100H
Wurm, G. E.; Urquijo, R. R. y Marinelli, M.J., 2019. Monitoreo en tiempo real de conductividad eléctrica en cultivos hidropónicos. En: 48JAIIO – CAI, pp.96-103. ISSN: 2525-0949.
Zambrano Sánchez, N.; Camelo Quintero, E.; Méndez González, A. y Valderrama Lugo, Y., 2019. Diseño e implementación de un instrumento electrónico de medida de pH para terreno agrícola. En: Revista Investigación e Innovación en Ingenierías, 7(1), pp.72-94. DOI: https://doi.org/10.17081/invinno.7.1.3042


