En gran parte del territorio uruguayo las infestaciones de la garrapata del ganado, Rhipicephalus microplus, constituyen el mayor problema de ectoparásitos, provocando pérdidas directas e indirectas, entre ellos muertes por la trasmisión de Babesia sp. y Anaplasma sp., baja productividad, presencia de trazas químicas en la carne, leche y derivados, así como también resistencia cruzada a la limitada oferta de moléculas acaricidas. Por tal motivo, el desarrollo de herramientas biológicas que recompongan la biodiversidad afectada e inicien un proceso de regeneración del campo natural, ecosistema principal involucrado en la producción ganadera, resultará en múltiples ventajas. En 33 sitios diferentes de Uruguay se colectaron muestras de suelo con el objetivo de prospectar hongos acaropatogénicos, obteniendo un total de 16 aislamientos. Los estudios in vitro permitieron la selección de 3 cepas, correspondientes a las especies de Mertarhizium anisopeliae, Akantomyces muscarius y Beauveria bassiana, las cuales mostraron diferencias en la patogenicidad sobre distintas fases evolutivas de R. microplus. Si bien es importante realizar nuevos ensayos de campo para determinar el potencial real, el presente trabajo arroja información promisoria sobre el efecto de la disminución de R. microplus a partir de la tercera aplicación de una mezcla de cepas (Akantomyces muscarius, Beauveria bassiana y Metarhizium anisopliae) tanto en concentraciones de 107 como de 108 con/mL.
Palabras clave: Metarhizium anisopliae, Akantomyces muscarius, Beauveria bassiana, control biológico, microorganismos nativos.
Em grande parte do território uruguaio, as infestações do carrapato bovino, Rhipicephalus microplus, constituem o maior problema ectoparasitário, causando perdas diretas e indiretas, incluindo mortes por transmissão de Babesias sp. e Anaplasma sp., baixa produtividade, presença de vestígios químicos em carnes, leite e derivados, bem como resistência cruzada à oferta limitada de moléculas acaricidas. Por esta razão, o desenvolvimento de ferramentas biológicas que reconstruam a biodiversidade afectada, reduzam a pressão química e iniciem um processo de regeneração da paisagem natural, principal ecossistema envolvido na produção pecuária, resultará em múltiplas vantagens. Em 33 locais diferentes no Uruguai foram coletadas amostras de solo com o objetivo de prospecção de fungos patogênicos para ácaros, obtendo-se um total de 16 isolados. Os estudos in vitro permitiram a seleção de três cepas, correspondentes às espécies de Mertarhizium anisopeliae, Akantomyces muscarius e Beauveria bassiana, que apresentaram diferenças na patogenicidade ao longo das diferentes fases evolutivas de R. microplus. Embora seja importante a realização de novos ensaios de campo para determinar o real potencial, o presente trabalho fornece informações promissoras sobre o efeito da redução de R. microplus a partir da terceira aplicação de uma mistura de cepas (Akantomyces muscarius, Beauveria bassiana e Metarhizium anisopliae) ambas nas concentrações de 107 e 108 con/mL.
Palavras-chave: Metarhizium anisopliae, Akantomyces muscarius, Beauveria bassiana, controle biológico, microorganismos nativos.
Introducción
En gran parte del territorio uruguayo, las infestaciones de la garrapata del ganado, Rhipicephalus microplus (Acari: Ixodidae), constituyen el mayor problema de ectoparásitos debido a la aptitud ecológica favorable a su desarrollo (Solari et al., 2013). Las pérdidas que superan los 45 millones de dólares al año son directas e indirectas (Cuore y Solari, 2022), entre ellas muertes de vacunos por la trasmisión de Babesia sp. y Anaplasma sp., baja productividad, presencia de trazas químicas en la carne, leche y derivados (Ojeda Chi et al., 2011), resistencia cruzada a la limitada oferta de moléculas acaricidas (Cuore y Solari, 2014). También se deben considerar los efectos tóxicos que producen estas moléculas. La ivermectina causa un daño notable e imperceptible a la salud humana y a la biodiversidad, disminuyendo poblaciones de escarabajos estercoleros que son fundamentales en el proceso de reciclado de la materia orgánica y control de otras plagas como la mosca de los cuernos Haematobia irritans (L) (Aparicio-Medina et al., 2011; Souza, 2021). El fipronil a bajas concentraciones también es tóxico para especies no destino, incluyendo las abejas y numerosos macroinvertebrados acuáticos y terrestres (Gómez-Beltrán et al., 2023).
En el panorama global, la agricultura y ganadería enfrentan desafíos como los suelos degradados, la pérdida de la biodiversidad, el cambio climático y la creciente demanda de alimentos inocuos y nutritivos. La FAO plantea que la agricultura tradicional debe realizar una transición agroecológica hacia una agricultura sostenible, donde se garantice la seguridad alimentaria mundial, y se satisfagan las necesidades de las generaciones presentes y futuras con una gestión sostenible de la tierra, el agua y los recursos naturales (FAO e INRA, 2015).
Uruguay posee una histórica preocupación por el control de esta plaga, visible desde que se promulgó la Ley N° 3.606 en 1910 (Uruguay, 1910). Actualmente se encuentra vigente la Ley N° 18.268 (Uruguay, 2008), que declara de interés nacional la lucha contra la garrapata bovina. Esta ley tiene por cometido el control y/o erradicación del parásito dependiendo de la zona en la que se encuentra, y el monitoreo del tránsito de animales de una zona a la otra para evitar su propagación (Errico et al., 2009). Por otro lado, desde 2019 existe la Ley N° 19.717 (Uruguay, 2019), la cual declara de interés general y crea una Comisión Honoraria Nacional y el Plan Nacional para el Fomento de la Producción con Bases Agroecológicas, donde el desarrollo de alternativas de control biológico son parte de la apuesta.
Las condiciones ambientales del territorio determinan que la garrapata puede realizar entre dos y tres generaciones anuales, con variaciones entre las diferentes regiones, principalmente en el número de garrapatas (Cuore et al., 2013). Entre mayo y agosto se ubica el ciclo no parasítico de la plaga, quedando en el suelo y sobre pastos los huevos que hibernan a la espera de las condiciones ambientales para eclosionar (Nari y Fiel, 1994). Cada hembra puede dejar más de 4500 huevos (Cuore et al., 2013). En campos abrigados la primera generación comienza entre julio y agosto, extendiéndose hasta octubre y noviembre con el consiguiente incremento de garrapatas por animal. La segunda generación va desde noviembre a comienzos del otoño y en otoño se da la tercera generación, llegando a más de 400 garrapatas por animal (Ministerio de Ganadería Agricultura y Pesca, Dirección de Servicios Veterinarios, 1994).
El control de R. microplus se ha realizado casi exclusivamente con la aplicación de acaricidas químicos, que actúan solo sobre el ciclo parasitario (5 % de la problemática de la parasitosis) y tienen efectos adversos para el medio ambiente (Kunz y Kemp, 1994). Además del costo que generan, su presión desmedida ha favorecido la aparición de resistencia a cinco de los seis grupos de acaricidas. En 1950 se detectaron en Uruguay poblaciones de R. microplus resistentes a los arsenicales (Cardozo y Franchi, 1994), luego se constató resistencia a los organofosforados en 1978 (Petraccia et al., 1983), y en 1994, a los piretroides sintéticos y sus mezclas (Cardozo y Franchi, 1994). En 2006 se descubrió la resistencia a los fenilpirazoles (Cuore, 2006); en 2009, a las amidinas (Cuore et al., 2012); y en 2010, a las lactonas macrocíclicas (Castro-Janer et al., 2012). Existe duda acerca de la resistencia a fluazuron, pero no se cuenta a nivel nacional con diagnósticos oficiales.
Debido a esto, se vuelve necesario encontrar alternativas basadas en el control integrado que sean eficaces en la reducción y control de las infestaciones, respetuosas con el medio ambiente y cuya toxicidad sea baja, como respuesta a los principios de una ganadería sostenible y enfoque de una sola salud (Álvarez et al., 2017).
Existe una tendencia mundial de poner la mirada en la gran diversidad de reguladores naturales, buscando su efectividad mediante un manejo integrado a las buenas prácticas ganaderas. Entre los reguladores naturales se encuentran vertebrados, invertebrados y patógenos (Verrisimo, 1995 y 2013). Pero la mayor diversidad está en el suelo, los cuales han sido ampliamente estudiados y citados por diversos autores (Samnsinakova, 1977; Bittencourt et al., 2003; Angelo et al., 2010; Fernandes et al., 2012; Webster et al., 2017). Esto permite comprender por qué no son aún mayores los niveles de infestación si la cantidad de huevos que oviposita una hembra de R. microplus ronda los 4000, con una viabilidad por encima del 90 %. Por lo tanto, es necesario encontrar medidas de control que potencien la acción de los reguladores naturales sobre el ciclo no parasitario de la plaga, que ocurre a nivel del suelo y que representa el 95 % de la problemática de la parasitosis.
Los hongos patogénicos de garrapatas
Existen más de 750 especies de hongos entomopatógenos; y dentro de los géneros más importantes están: Metarhizium, Beauveria, Aschersonia, Entomophthora, Zoophathora, Hirsutella y Akantomyces (Pucheta-Díaz et al., 2006).
Metarhizium spp. es patógeno de un amplio grupo, se lo puede encontrar en el suelo, la rizosfera de plantas, los cadáveres de artrópodos y como saprófito y parásito de varios insectos y garrapatas (Schrank y Vainstein, 2010). Sus formas más importantes de dispersión son los conidios, los cuales se adhieren a sus hospedadores, comenzando así la infección. La forma de infección más común es por contacto directo con el hongo, aunque también existe la transmisión horizontal, de un individuo infectado a uno sano (Gutiérrez et al., 2016).
El género Metarhizium requiere alta humedad (cerca del 100 %) y temperatura moderada de 25 ℃ (Ment et al., 2010) para infectar a un amplio rango de hospederos pertenecientes a diferentes órdenes y especies (Ojeda-Chi et al., 2011). En el caso particular de R. microplus, diversos autores mencionan esta capacidad (Frazzon et al., 2000; Bittencourt, 2000; Moreno et al., 2001; Fernández et al., 2005; Hornbostel et al., 2005; Bahiense et al., 2006; Ment et al., 2010; Pulido-Medellin et al., 2015,); ya sea solo, en combinación con varias cepas de esta especie o junto con B. bassiana (Beys et al., 2020). Pruebas de laboratorio y de campo han demostrado que M. anisopliae es eficaz en el control de garrapatas del ganado, y puede ser una alternativa interesante, manteniendo la plaga por debajo de los niveles de daño económico (Samish y Rehacek, 1999; Frazzon et al., 2000; Ojeda-Chi et al., 2010 ; Schrank y Vainstein, 2010, Arguedas et al., 2020, Alonso-Diaz et al., 2022). Su acción acaropatogénica incluye además la afectación sobre parámetros reproductivos como la disminución de la masa de huevos y su eclosión (López et al., 2009; Fernández-Salas et al., 2017).
Al hongo Akantomyces lecanii es común encontrarlo ejerciendo su acción patogénica con temperaturas relativamente más bajas que Metarhizium spp., entre 17 y 23 ℃ (Rodríguez dos Santos, 2003), sobre diversas plagas de la agricultura, así como también en la ganadería sobre R. microplus (Rijo et al., 1998; Moreno et al., 2001; Beltran-Alzate, 2008). Fassiatiova et al., (1978) y Gindin et al., (2001) señalan que los cadáveres de los artrópodos atacados por este hongo presentan una cubierta blanca de largos filamentos que emergen del interior de aquellos con un aspecto generalmente algodonoso (Hall y Atkey, 1981).
Beauveria spp. es otro patógeno de plagas de importancia económica, entre ellas de ácaros como R. microplus y R. annulatus. Diversos autores han realizado investigaciones tanto in vitro como a campo sobre esta capacidad de Beauveria spp. (Moreno et al., 2001; De La Cruz y Vahos, 2004; Cardona, 2005; Fragas et al., 2006; Piralhi-Kheirabadi et al., 2007; Posadas y Lecuona, 2009; Tofiño Rivera et al., 2018; Yari Briones et al., 2021; Martínez-García et al., 2023). En combinación con cepas de M. anisopliae se inducen mayores mortalidades de garrapatas, lo que puede atribuirse al aumento de la letalidad que produce la combinación de las micotoxinas y enzimas producidas por cada especie (Maranga et al., 2005; Zeina et al., 2022).
Una de las características más importantes de la capacidad de patogenicidad de esos microrganismos sobre R. microplus es que las esporas de los hongos interactúan hidrofóbicamente con la capa lipídica de la cutícula (Bidochka et al., 1994) mediante proteínas apolares, llamadas hidrofobinas (St. Leger, 1993), adhesinas, como MAD1, GAPDH (Gluceraldehído-3-fosfato deshidrogenasa) y fosfatasas (Wang y St. Leger, 2007). Además de estas proteínas, las enzimas lipolíticas pueden contribuir al reconocimiento y adhesión a través del aumento potencial de superficie de hidrofobicidad por degradación de lípidos (Beys da Silva et al., 2010). La capacidad de estos hongos para reconocer los componentes lipídicos de la cutícula de la garrapata es lo que induce a niveles más altos de actividad de lipasa y esterasa (Beys da Silva et al., 2010). La producción de toxinas, proteínas y metabolitos secundarios como ácidos hidroxicarboxílicos, ácido dipicolínico, fenilalanina anhidra, 2,6 dimetoxi-p-benzoquinona, aphidicolina, ácido picolinico, ácido cítrico y oxálico (Bidochka et al., 1994), disminuyen la capacidad reproductiva (Angelo et al., 2012), inhiben los hematocitos, la función muscular y la función del túbulo de Malpighian, así como la supresión del sistema inmunológico del huésped (Bidochka et al., 1994; Pal et al., 2007; Santi et al., 2019).
Los síntomas de patogenicidad fúngica en garrapatas incluyen sensibilidad reducida, movimientos descoordinados y parálisis, que conducen a la muerte del artrópodo. Al ser hemibiótrofos, continúan viviendo en el cadáver como saprófitos, las hifas invaden órganos internos hasta agotar los nutrientes y luego, en condiciones favorables, emergen y forman nuevamente las esporas (Esser et al., 1994, Carballo y Guharay, 2004), las que podrán diseminarse por el ambiente para recomenzar el ciclo en otros individuos. En la Figura 1 se presenta dicho ciclo en forma esquemática.
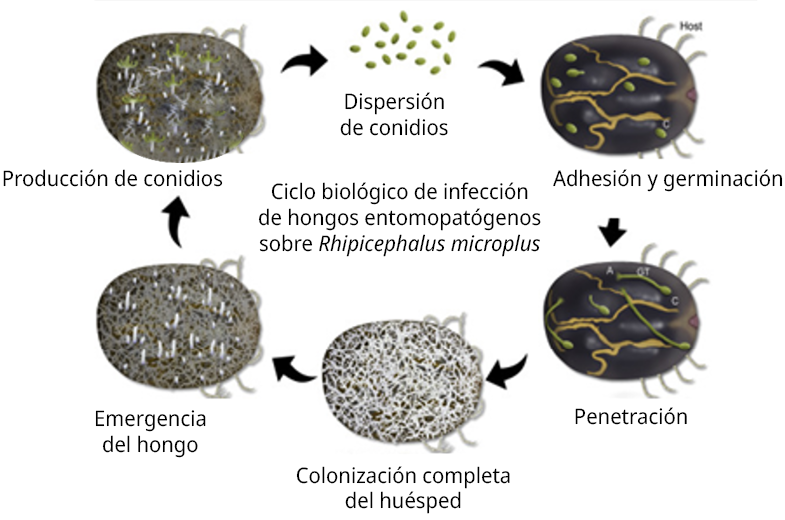
Figura 1. Ciclo biológico de infección (Shah y Pell, 2003; Schrank y Vainstein, 2010).
Algunos autores mencionan el efecto de la combinación de cepas de M. anisopliae y B. bassiana para provocar una mayor mortalidad de garrapatas, lo que es inducido por la combinación de micotoxinas y enzimas producidas por cada una de las especies fúngicas, que se vuelven más letales cuando se combinan (Maranga et al., 2005; Beys da Silva et al., 2020). Ojeda-Chi et al. (2010) muestran la disminución de la oviposición de hembras congestionadas de R. microplus tratadas con formulaciones combinadas de diferentes cepas de M. anisopliae.
Como se ha evidenciado anteriormente, la investigación sobre hongos patogénicos de R. microplus es extensa, tanto en laboratorio como campo, a nivel mundial y en países vecinos como Brasil (Frazzon et al., 2000; Bittencourt et al., 2003; Bahiense et al., 2006; Beys da Silva et al., 2020; Santos et al., 2022). Algunos países como Estados Unidos ya cuentan con productos comercializables de la especie M. anisopliae (Sullivan et al., 2022).
En Uruguay se realizan experiencias de campo desde el 2016 mediante convenios entre asociaciones de productores (Cooperativa de Productores de Leche de Tacuarembó, Liga de Trabajo de Fraile Muerto, Liga de Trabajo de Guichón, Sociedad Fomento Rural de Curticeiras, Cooperativa Agraria de Aigua), BIO Uruguay, la Dirección General de Desarrollo Rural del Ministerio de Ganadería, Agricultura y Pesca (MGAP), el Instituto Plan Agropecuario y la Universidad del Trabajo de Uruguay (Uruguay. Ministerio de Ganadería, Agricultura y Pesca, 2022, 2023a, 2023b; Contexto Ganadero, 2023). Además, desde las autoridades sanitarias del MGAP, Cuore y Solari (2022) señalan que el principal desafío que Uruguay enfrenta es generar conocimiento sobre alternativas biológicas de control de la garrapata bovina.
Materiales y Métodos
Prospección y obtención de aislamientos
Entre los años 2008 y 2021 se llevó adelante la prospección para la obtención de microorganismos nativos en 33 sitios bajo ganadería extensiva en cinco departamentos del norte y este del país. El suelo de este ecosistema, caracterizado por su riqueza de especies vegetales, aloja aún una alta biodiversidad de hongos acaropatogénicos. Los aislamientos se realizaron a partir de muestreo de suelo y de garrapatas infectadas. La metodología usada para la obtención de aislamientos desde el suelo fue mediante insectos trampa, según Rodríguez dos Santos et al. (2018). Se extraen muestras de los primeros 10 cm de suelo en diferentes sitios (lugares donde se reúnen los animales, sitios con mayores contenidos de materia orgánica o suelos de agroecosistemas más conservados). Estas componen una muestra que se coloca en un recipiente limpio con tapa, se rotula con el nombre del establecimiento y/o coordenadas de donde fue tomada la muestra y la fecha en la que se tomó. En el laboratorio se mezcla muy bien la muestra y se extraen 15 g de suelo para colocar en recipientes limpios junto a diez larvas de Gallería mellonella (insectos trampa). Se incuban durante 7-10 días a temperatura controlada entre unos 24 ℃ ± 2 ℃.
Luego de ese período se extraen aquellas larvas de G. mellonella con síntomas de enfermedad o muertas, que presentan cambio de color y secas, las que se incuban nuevamente durante 7 a 10 días para dar lugar a la expresión del agente causante de la enfermedad o muerte. Posteriormente se procede al aislamiento de los hongos por medio de diluciones seriadas o con punta de ansa estéril. Luego de obtener cepas puras se realiza la determinación taxonómica. La identificación de género se basa en las características de crecimiento de los hongos sobre el cadáver del insecto, las características culturales, la morfología y disposición de células conidiógenas y conidios, y la identidad del hospedante, según lo recomiendan Goettel e Inglis (1997) y Humber (1997).
Para la caracterización macroscópica se tomaron discos de 5 mm de diámetro de los diferentes aislamientos y se colocaron en placas Petri (90 mm), que contenían Saboraud Dextrosa Agar (SDA), incubándose en oscuridad continua a 25 ℃. A los 10 días se midió el crecimiento micelial de las colonias, y se anotaron las siguientes características culturales: aspecto, color de ambas superficies de la colonia, borde y velocidad de crecimiento.
En el caso de la caracterización microscópica, se realizaron microcultivos sobre portaobjetos con agar agar al 2 %, observándose a las 48 y 72 horas con la ayuda de un microscopio binocular (aumento 900 x) la morfología y disposición de las células conidiógenas y los conidios. Los aislamientos se identificaron mediante las claves y descripciones de géneros hechas por Brady (1979), Humber (1997), y Wraight et al. (1998); para proceder al primer bioensayo en busca de seleccionar algunos de los aislamientos que muestren capacidad acaropatogénica sobre R. microplus, los cuales seguirán adelante en el proceso de evaluación/selección con previa identificación molecular.
Bioensayos
Los aislamientos obtenidos en el paso anterior se usaron para las pruebas de patogenicidad sobre garrapatas. Todos los ensayos se realizaron en forma progresiva en el laboratorio Centro de Reproducción de Entomopatógenos (CREBIO) del Batoví Instituto Orgánico (BIO Uruguay Internacional), situado en la localidad de Zapará, Departamento de Tacuarembó, Uruguay.
Un primer bioensayo se realizó con el objetivo de conocer cuáles de estos aislamientos mataban el mayor número de garrapatas en un tiempo determinado, como acercamiento a las capacidades acaropatogénicas que permitieran la selección de un número menor de aislamientos para proceder a las siguientes evaluaciones. Para ello se extrajeron hembras adultas de R. microplus de más de 4 mm de vacunos con más de 45 días de la última aplicación de acaricidas. Las mismas se depositaron en frascos de vidrio de boca ancha (7 cm de diámetro), se lavaron con agua esterilizada y se sumergieron durante un minuto en solución de hipoclorito de sodio al 1 % para desinfectarlas (Gindin et al., 2001). Posteriormente 100 hembras de R. microplus (por cada aislamiento) estuvieron en inmersión durante 10 minutos en una suspensión de 1 x 108 con/mL, quedando depositadas en cámara húmeda a 24 ℃ ± 2 ℃. Las suspensiones conidiales se obtuvieron, tal como describen Goettel y Inglis (1997), a partir de colonias puras que crecieron sobre SDA durante 20 días en la oscuridad y a temperatura de 25 ℃.
Las concentraciones fueron determinadas con una cámara de Neubauer y ajustadas convenientemente. A los 20 días se contabilizaron las garrapatas muertas y con presencia visible de desarrollo de los respectivos hongos, determinándose con estos datos la mortalidad absoluta expresada en porcentaje. Se seleccionaron los aislamientos que mostraron porcentajes de mortalidad mayores al 60 % y se enviaron para su identificación molecular al Instituto Nacional de Investigación Agropecuaria (INIA) Uruguay. En el informe de dicha institución consta que las muestras identificadas con cultivos del género Akantomyces fueron repicadas para obtener cultivos puros, luego se obtuvo ADN genómico, que fue amplificado con los cebadores Bt2a y Bt2b (Glass y Donaldson, 1995). El producto de amplificación fue secuenciado con el cebador Bt2b y la secuencia obtenida fue alineada con secuencias de especies relacionadas. El alineamiento obtenido se usó para realizar un análisis mediante Maximum Likelihood con el programa Mega6 (Tamura et al., 2013).
De las muestras identificadas con cultivos del género Metarhizium, el ADN fue amplificado con los cebadores EF1T y 1567 para el gen que codifica el factor de elongación 1-alfa, usado como marcador filogenético (Rehner y Buckley, 2005). El producto de PCR fue secuenciado con los mismos cebadores por Macrogen (Corea). Las secuencias obtenidas fueron incluidas, junto a secuencias de cepas tipo de especies de Metarhizium relacionadas, en un análisis filogenético realizado por el método de Máxima Parsimonia con el programa MEGA6 (Tamura et al., 2013), reconstruyendo la filogenia de Metarhizium propuesta por Bischoff et al. (2009).
El ADN obtenido del aislamiento del género Beauveria fue amplificado mediante PCR con los cebadores que amplifican el factor de elongación (Carbone y Kohon, 1999), y luego se realizó un análisis filogenético por el método Maximum Likelihood.
Con estos tres aislamientos identificados a género y especie se procedió a la realización de bioensayos para determinar la capacidad acaropatogénica de los mismos sobre diferentes estados de desarrollo de la plaga. Por practicidad en la manipulación de los estados de desarrollo se usó como criterio de clasificación el tamaño de las garrapatas, dividiendo la población en dos grupos, los individuos menores a 4 mm y mayores a 4 mm. En ambos casos se evaluó cada aislamiento en tres diferentes concentraciones (C1 = 106 con/mL, C2 = 107 con/mL y C3 = 108 con/mL).
Los individuos de garrapatas se limpiaron y se distribuyeron en tres grupos de 10 (un total de treinta individuos por aislamiento y por concentración), los que estuvieron inmersos durante 1 minuto en la suspensión correspondiente. La técnica de inmersión de las garrapatas fue adaptada de Drummond y Whetstone (1969). Hubo un tratamiento testigo en el cual las garrapatas se sumergieron en agua estéril por el mismo tiempo.
Posteriormente se depositaron en cámara húmeda (24 ℃ ± 2 ºC y 90 % HR) sobre papel secante previamente esterilizado. En todos los individuos de garrapatas se evaluó la mortalidad a los 4, 8 y 13 días, y la presencia visible de micelio de hongo. La patogenicidad de los hongos sobre las garrapatas fue evaluada según la metodología de Bittencourt (2000).
En un grupo de garrapatas teleóginas se evaluó el efecto de la inhibición de la postura y eclosión. Para ello se las colocó en tres grupos de 10 (con el tratamiento previo de lavado e inmersión en la suspensión con hongo como fue explicado) en cámara húmeda durante 35 días (a 28 ºC y 90 % de HR). Luego se extrajeron los huevos de cada grupo, los cuales se pesaron con balanza de precisión y posteriormente fueron depositados nuevamente en placas Petri cerradas durante 65 días, esperando la eclosión.
La inhibición de la postura se calculó mediante la siguiente fórmula:

Para calcular la eclosión de larvas se tomaron tres alícuotas y se contabilizaron los cascarones rotos y no rotos hasta completar 100 huevos contados. Con los resultados se obtuvo el promedio de eclosión por tratamiento.
Bioensayo a campo
Durante los meses de marzo a mayo de 2021, un rodeo de 36 vacunos adultos con presencia natural de garrapatas fue dividido en cuatro grupos de 9 vacas cada uno. Se realizó un conteo de garrapatas dejando 50 mayores a 4 mm por animal (contabilizados del lado izquierdo). El grupo control fue tratado con agua, mientras que los otros tres fueron tratados con una suspensión de una mezcla de conidios de los aislamientos seleccionados. Estos aislamientos fueron anteriormente seleccionados en estudios de laboratorio por su capacidad patogénica sobre las diferentes etapas de desarrollo de la plaga, su efecto sobre los parámetros reproductivos y los diferentes requerimientos de humedad y temperatura, para abarcar así las diferentes estaciones en las cuales se desarrollan las generaciones de la plaga.
Las suspensiones de diferentes concentraciones se obtuvieron a través del cultivo de hongos sobre arroz en bolsas de polipropileno, como describe Rodríguez dos Santos (2003), y luego se realizaron diluciones en serie hasta obtener la concentración requerida de 106, 107 y 108 con/mL (de cada hongo por separado) mezclando volúmenes iguales de la misma concentración de cada cepa.
Los vacunos fueron tratados quincenalmente con aplicaciones de las suspensiones de hongos asperjando con mochila, usando 1 litro por cada 100 kilos de peso vivo de animal (Rijo-Camacho, 2011), cada 15 días. Los tratamientos fueron realizados siempre de tardecita evitando alta irradiación y temperaturas elevadas.
Para evaluar la población de garrapatas sobre los vacunos (como indicador de la evolución de la población de garrapatas con los diferentes tratamientos) se contabilizó cada 15 días, previo a cada aplicación, el número de garrapatas mayores a 4 mm del lado izquierdo de cada animal, por cada grupo.
Diseño experimental y análisis estadístico
Los experimentos de laboratorio fueron diseños totalmente aleatorios, mientras que el experimento a campo se hizo con un diseño de bloques al azar. Los análisis de varianza fueron los propios de estos diseños. Para la mortalidad de garrapatas menores y los mayores a 4 mm, y el ensayo a campo se realizó un ANOVA de tres factores; mientras que para la inhibición y eclosión de los huevos el ANOVA fue de dos factores.
En todos los casos se realizaron los análisis con los datos originales y, posteriormente, con los datos transformados de conformidad con las exigencias de los estadísticos (Steel y Torrie, 1985).
En todos los casos se realizó ANOVA y posteriormente la prueba de comparación múltiple. Cuando se encontraron diferencias significativas en los análisis de varianza se aplicó la prueba de comparación de medias de Tukey al 5 % de probabilidad.
Resultados y Discusión
Se obtuvieron 16 aislamientos patogénicos de G. mellonella, de los cuales seis fueron caracterizados como pertenecientes al género Beauveria, cinco al género Metarhizium, tres al género Akantomyces, y uno al género Paecilomyces. Los aislamientos se encuentran criopreservados en el banco de cepas del laboratorio CREBIO del Batoví Instituto Orgánico-Uruguay. A continuación, en la Tabla 1 se muestran los resultados obtenidos:
Tabla 1. Mortalidad expresada en porcentaje a los 20 días de la aplicación del hongo sobre garrapatas adultas.
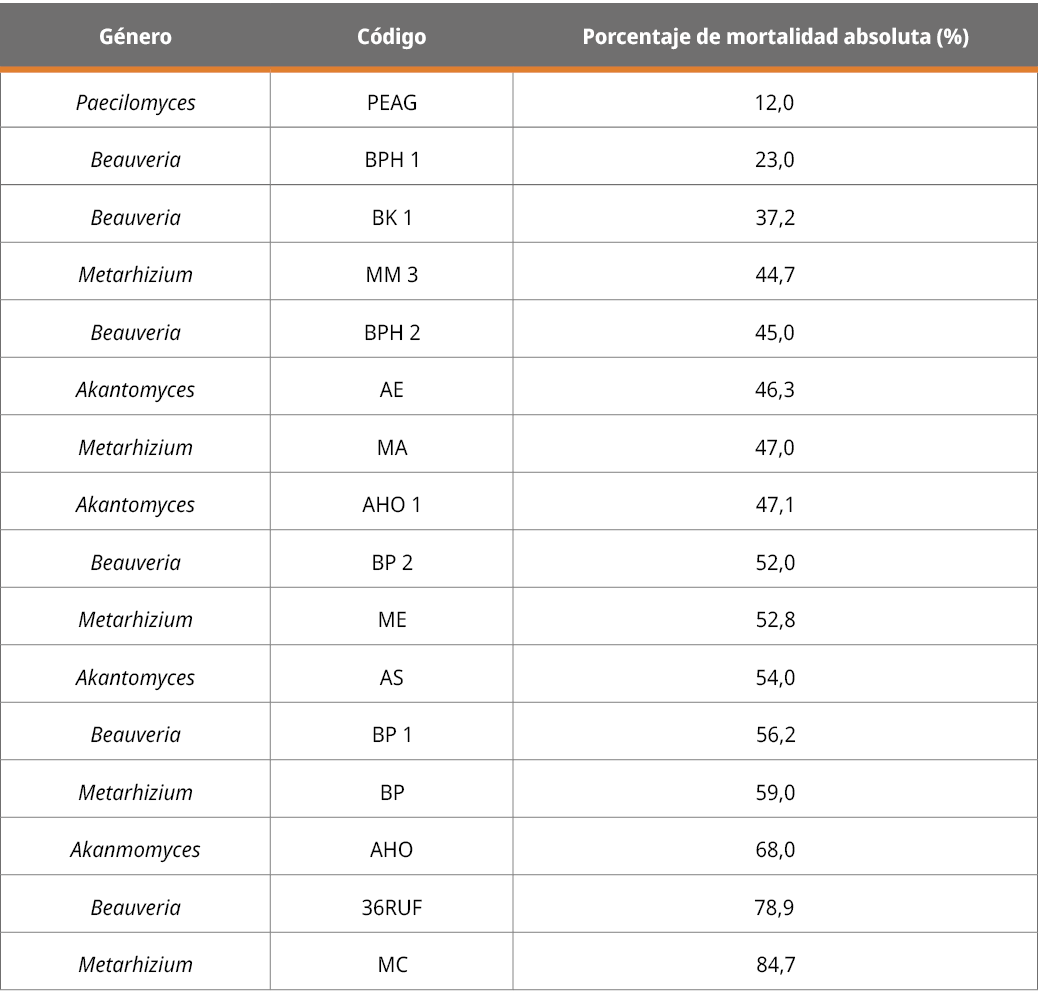
Los aislamientos que provocaron una mayor mortalidad de garrapatas (superior al 60 %), como se observa en la Tabla 1, correspondieron a aislamientos pertenecientes a los géneros Akantomyces (AH0), Beauveria (36RUF) y Metarhizium (MC), los cuales se presentan en la Figura 2. Los resultados de la identificación molecular de INIA mostraron que la cepa (AHO) de Akantomyces formó un clado con 62 % de soporte con cepas de Lecanicillium muscarium, actualmente Akanthomyces muscarius (Nicoletti y Becchimanzi, 2020). El análisis filogenético permitió identificar a la cepa (MC) de Metarhizium como perteneciente a la especie Metarhizium anisopliae sensu stricto en un clado con 95 % de soporte, que incluye la cepa tipo (ARSEF 7487) de la especie. Para la cepa (36RUF) de Beauveria, de acuerdo con las filogenias construidas a partir de las secuencias obtenidas, se determinó que pertenece a la especie Beauveria bassiana. Estos resultados de especies identificadas de hongos acaropatogénicos sobre R microplus concuerdan con la amplia bibliografía reportada en este artículo, en especial B. bassiana y M.anisopliae.
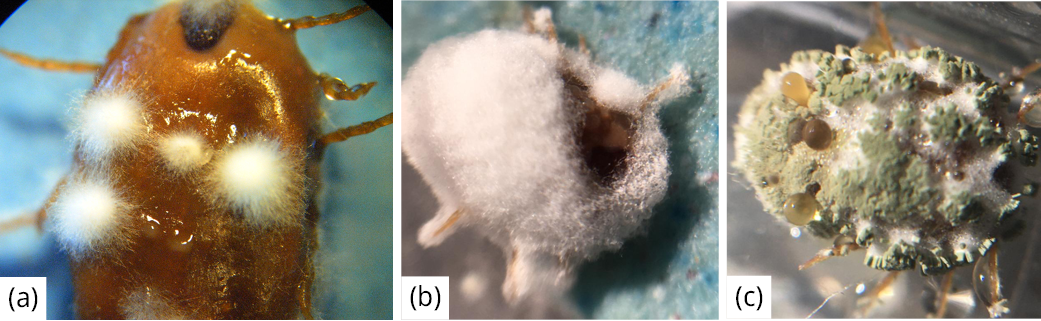
Figura 2. Garrapata adulta infectada con (a) Akantomyces muscarius, (b) Beauveria bassiana y (c) Metarhizium anisopliae.
En la Tabla 2 se muestran los datos de los resultados correspondientes a la mortalidad del grupo de garrapatas de menor desarrollo (hasta 4 mm) con cada cepa (36RUF, MC, y AHO) en las tres diferentes concentraciones (C1 = 1x106, C2 = 1x107, C3 = 1x108 con/mL).
Tabla 2. Patogenicidad de las diferentes cepas, en diferentes concentraciones, en el grupo de garrapatas de las primeras etapas de desarrollo (expresado en porcentaje de mortalidad a los 13 días).
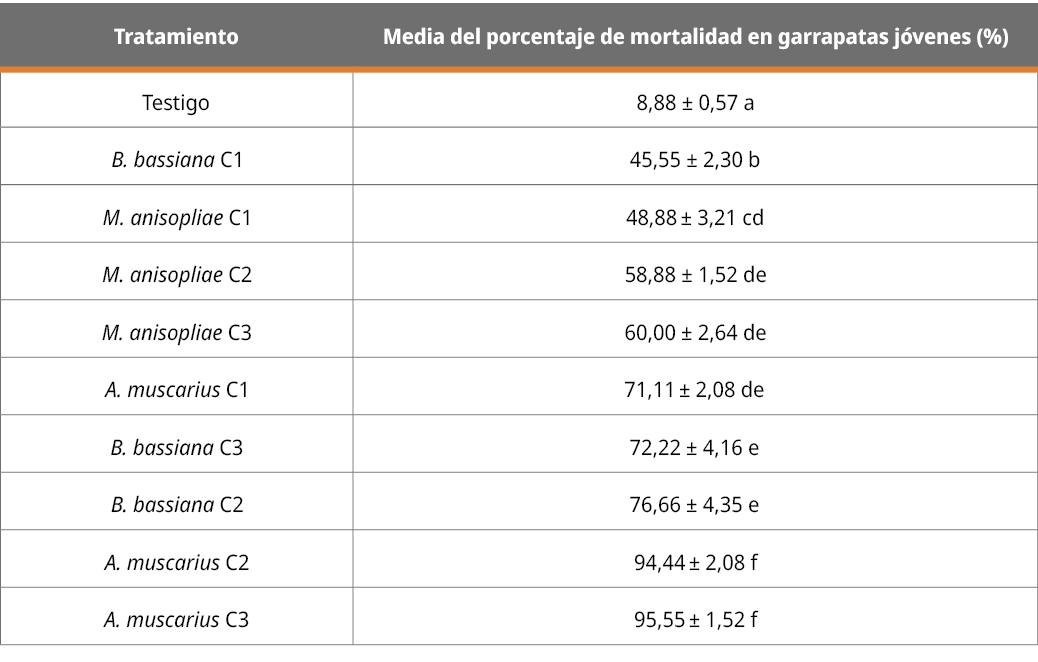
Letras diferentes indican diferencias significativas (p < 0,05; desvío estándar = 0.38).
Sobre garrapatas menores a 4 mm se observan diferencias significativas (p < 0,05) en todos los tratamientos en relación con el testigo. El mayor efecto de patogenicidad visible a través de la mortalidad corresponde a la cepa de A. muscarius en las dos concentraciones más altas (107 y 108 con/mL), sin diferencias significativas entre estas dosis y con diferencias significativas de los demás tratamientos. B. bassiana y M. anisopliae en las concentraciones más altas (107 y 108 con/mL) no mostraron diferencias significativas con A muscarius en su dosis más baja, concluyendo que A muscarius es la cepa más patogénica sobre garrapatas de menor desarrollo.
En la Tabla 3 se presentan los datos de los resultados correspondientes a la mortalidad del grupo de garrapatas de mayor desarrollo (mayores a 4 mm) con cada cepa y en las tres diferentes concentraciones mencionadas en Tabla 2 (C1, C2 y C3).
Tabla 3. Patogenicidad de las diferentes cepas, en diferentes concentraciones, en el grupo de garrapatas de las últimas etapas de desarrollo (expresado en porcentaje de mortalidad a los 13 días), mayores a 4 mm.
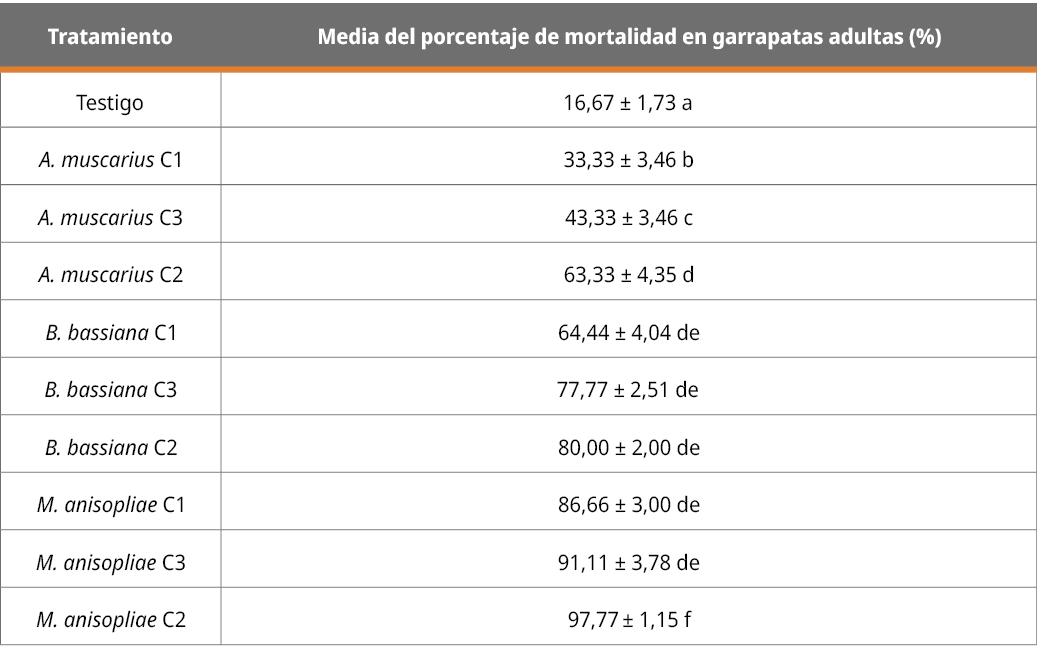
Letras diferentes indican diferencias significativas (p < 0,05; desvío estándar = 1,55).
Para este grupo de desarrollo también se observaron diferencias significativas (p < 0,05 %) en la capacidad patogénica de todos los aislamientos en las tres concentraciones en relación con el tratamiento testigo. Las cepas de M. anisopliae y B. bassiana en cualquiera de las tres concentraciones, y la de A. muscarius en la concentración de 107 con/mL, no mostraron diferencias significativas. Los resultados concuerdan con el efecto acaricida encontrado por Beltran-Alzate, (2008), Fernández-Salas (2017) y Martínez-García et al., (2023).
El efecto de los tratamientos sobre la inhibición de la oviposición se presenta a continuación:
Tabla 4. Porcentaje de inhibición de la oviposición (%).
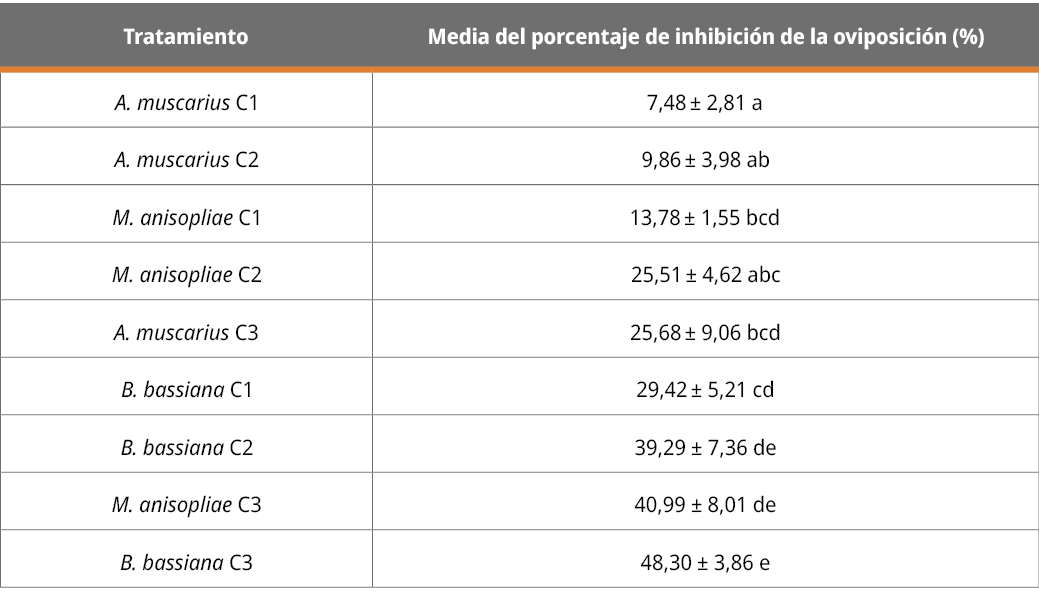
Letras diferentes indican diferencias significativas (p < 0,05; desvío estándar = 14,62).
Los resultados, tal como se observa en Tabla 4, muestran que todos los aislamientos en las diferentes concentraciones (con excepción de la menor concentración de A. muscarius) presentan diferencias significativas en la inhibición de oviposición respecto al testigo. El resultado de la cepa de B. bassiana concuerda con los autores Yari Briones et al. (2021), quienes también reportan la capacidad inhibitoria de esta especie sobre la oviposición. Asimismo, autores como Fernandez-Salas et al. (2017) destacan el efecto de M. anisopliae en la reducción de la masa de huevos, considerándolo muy importante pues de esta forma se reducen las poblaciones o infestaciones en el campo.
El efecto de los diferentes tratamientos (cepas y concentraciones) sobre la eclosión de huevos se presenta a continuación, mediante la evaluación del porcentaje de larvas nacidas, contabilizadas a partir de los cascarones rotos y no rotos.
Tabla 5. Efecto de los tratamientos sobre la eclosión de huevos, contabilizados a partir de cascarones vacíos en porcentaje.
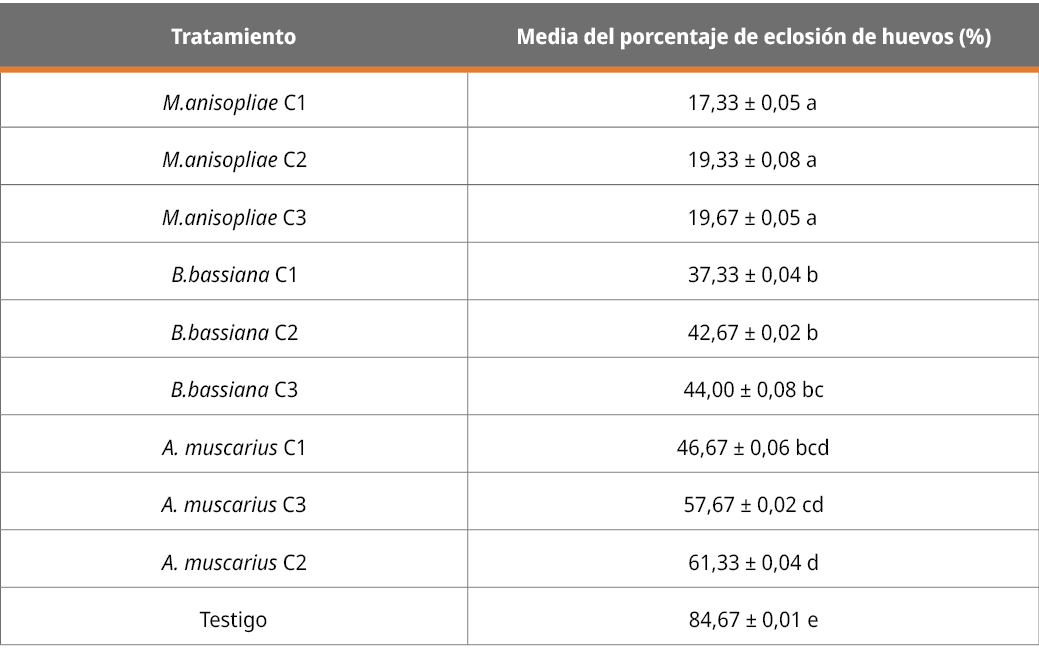
Letras diferentes indican diferencia significativa (p < 0,05; desvío estándar = 0,21).
Los resultados del efecto de los tratamientos sobre el nacimiento de larvas muestran que todos los aislamientos en las diferentes concentraciones fueron capaces de inhibir la eclosión de garrapatas con diferencias significativas (p < 0,05%) respecto al testigo. El tratamiento con M. anisopliae fue el que más influyó en este parámetro, sin diferencias significativas según las concentraciones y con diferencias significativas en relación con los demás tratamientos de las otras cepas en cualquiera de sus concentraciones. Estos resultados corroboran la información de López et al. (2009) sobre el efecto de M anisopliae en la disminución de nacimientos de larvas.
Siendo A. muscarius la cepa que mostró mejores capacidades de patogenizar las primeras etapas de desarrollo de garrapatas, y B. bassiana junto a M. anisopliae de afectar los parámetros reproductivos, se pensó que una combinación de estas cepas puede brindar los mejores resultados en la disminución poblacional de las garrapatas. Por esta razón se definió realizar el ensayo de campo con una combinación de las tres cepas, en diferentes concentraciones (106, 107, 108 con/mL).
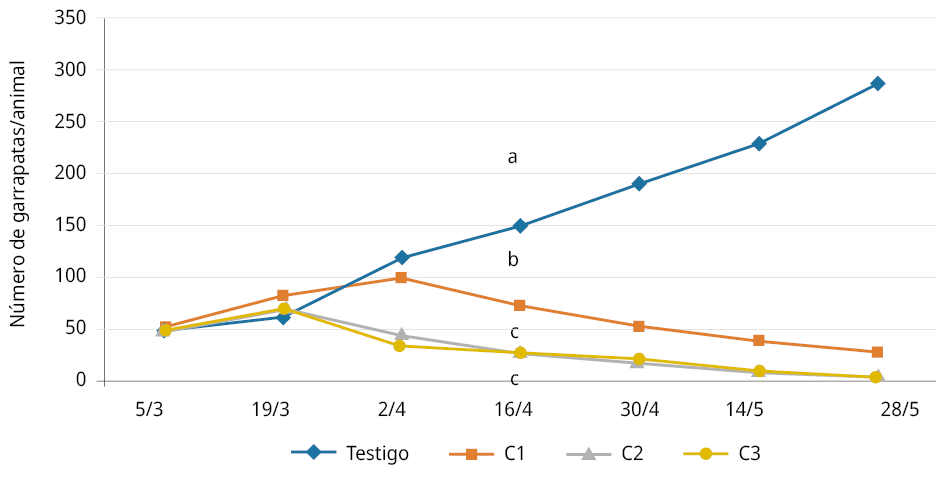
Letras diferentes indican diferencias significativas a partir de los 45 días del inicio del tratamiento.
Figura 3. Bioensayo a campo. Evolución del promedio del número de garrapatas por vacuno (p < 0,05; desvío estándar = 0,46).
El ensayo a campo mostró un aumento relativo de la cantidad de garrapatas por animal en los primeros 30 días en todos los tratamientos, aunque este incremento fue menor, tal como se aprecia en la Figura 5, en los tratamientos con hongos en relación al testigo con agua. Posteriormente y a partir de los 45 días (tercera aplicación), se comenzó a visualizar el potencial de disminución significativa de garrapatas sobre los animales tratados con las 3 diferentes concentraciones en relación con el tratamiento testigo con agua. Esta disminución de garrapatas se va acentuando al tiempo que en el tratamiento testigo crece la presencia de la plaga. Se resaltan los tiempos requeridos para evidenciar la acción patogénica a campo (45 días) y, por ende, la herramienta de control biológico para efectivizar el control y disminuir la infestación de la plaga por animal.
Al no haber diferencias significativas entre los tratamientos de 108 y 107 con/mL y sí con el tratamiento de 106 con/mL, se propone usar concentraciones de 107 con/mL.
Los ensayos de laboratorio mostraron que las cepas afectan con diferentes potenciales a cada etapa de desarrollo de la plaga, y la mezcla de hongos evidenció su potencial a campo, resultado acorde con los obtenidos por Zeina et al. (2022). Si bien los resultados a campo corroboran el potencial de control, es necesario y recomendable repetirlos en el tiempo para obtener conclusiones acerca de la efectividad real.
Conclusiones
El presente trabajo demuestra, en primer lugar, la riqueza de especies de hongos acaropatogénicos a través de la prospección realizada en suelos de Uruguay. A partir de una primera evaluación de dicha capacidad sobre R. microplus, se seleccionaron tres cepas para la realización de bioensayos que permitieran profundizar en el conocimiento, las cuales fueron identificadas molecularmente como Akantomyces muscarius, Beauveria bassiana y Metarhizium anisopliae.
Las evaluaciones sobre las diferentes fases de desarrollo de la garrapata y sobre su reproducción muestran el potencial de uso de estos agentes de control sobre la plaga, lo que representa un aporte importante ya que en Uruguay solo se dispone de ixodas químicos, a los cuales la plaga ha desarrollado resistencias.
Se infiere que el uso combinado de las diferentes cepas puede mejorar el potencial de control sobre la plaga debido a que cada una de ellas tiene capacidades patogénicas diferentes sobre los distintos estados de desarrollo de garrapatas, así como también sobre los parámetros reproductivos evaluados en este trabajo (oviposición y eclosión de los huevos).
Si bien es importante realizar nuevos ensayos de campo para determinar el potencial real, este trabajo arroja información promisoria sobre el efecto de la disminución de R. microplus a partir de la tercera aplicación de una mezcla de cepas (Akantomyces muscarius, Beauveria bassiana y Metarhizium anisopliae) tanto en concentraciones de 107 como de 108 con/mL.
Agradecimientos
A los Dres. Ing. Agr. Virginia Rossi (UDELAR) y Eduardo Chía (INRAE Francia) por el aporte incondicional y dedicada contribución para promover mejoras y motivar la generación de este material a partir de las experiencias prácticas. Al Ing Agr. Mag. José Fernando Restrepo H, por desarrollar los análisis estadísticos necesarios y aportar a su discusión.
Referencias
Alonso-Díaz, M.A.; Fernández-Salas, A.; Galindo-Velasco, E.; Lezama-Gutiérrez, R. y Contreras-Lara, R. 2022. Effect of Metarhizium anisopliae 1 (Ma14 strain) against Rhipicephalus microplus 2 on cattle infested naturally. En: Southwestern Entomologist, 47(2), pp. 285-290. DOI: https://doi.org/10.3958/059.047.0203
Álvarez, M.; Castillo, I.; Garrastazu, C.; Gonzalo, R. y Ordóñez, J., 2017. Dípteros y garrapatas: un problema de salud pública. Dípteros y garrapatas: un problema de salud pública uso responsable de los repelentes. Madrid: COFM. [Consulta 31 de octubre de 2023]. Disponible en: http://www.madrid.org/bvirtual/BVCM017994.pdf
Angelo, I.; Fernandes, E.; Bahiense, T.; Perinotto, W.; Golo, P.; Moraes, A. y Bittencourt. V., 2012. Virulence of Isaria sp. and Purpureocillium lilacinum to Rhipicephalus microplus tick under laboratory conditions. En: Parasitology Research, 111(4), pp. 1473–1480. DOI: https://doi.org/10.1007/s00436-012-2982-y
Angelo, I. C.; Fernandes, É. K. K.; Bahiense, T. C.; Perinotto, W. M. S.; Moraes, A. P. R.; Terra, A. L. M. y Bittencourt, V. E. P., 2010. Efficiency of Lecanicillium lecanii to control the tick Rhipicephalus microplus. En: Veterinary Parasitology, 172(3-4), pp. 317–322. DOI: https://doi.org/10.1016/j.vetpar.2010.04.038
Aparicio-Medina, J. M.; Paredes-Venegas, V.; González-López, O. y Navarro-Reyes, O., 2011. Impacto de la ivermectina sobre el ambiente [En línea]. En: La Calera, 11(17), pp. 64-66. [Consulta 31 de octubre de 2023]. Disponible en: https://lacalera.una.edu.ni/index.php/CALERA/article/view/144
Arguedas, M.; Álvarez, V. y Bonilla, R., 2020. Eficacia del hongo entomopatógeno Metarhizium anisopliae en el control de Boophilus microplus (Acari: Ixodidae) [En línea]. En: Agronomía Costarricense, Revista de Ciencias Agrícolas, 32(2), pp. 137-147. [Consulta 31 de octubre de 2023]. Disponible en: https://www.mag.go.cr/rev_agr/v32n02-137.pdf
Bahiense, T. C.; Fernandes, É. K. y Bittencourt, V.R.E.P., 2006. Compatibility of the fungus Metarhizium anisopliae and deltamethrin to control a resistant strain of Boophilus microplus tick. En: Veterinary Parasitology, 141 (3-4), pp. 319-324. DOI: https://doi.org/10.1016/j.vetpar.2006.05.011
Beltran-Alzate, C., 2008. Patogenicidad de Lecanicillium lecanii (fungi) sobre la garrapata Boophilus microplus (Acari: Ixodidae), en laboratorio. En: Revista Colombiana de Entomología, 34(1), pp. 90-97. [Consulta 31 de octubre de 2023]. Disponible en: http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0120-04882008000100012
Beys da Silva, W. O.; Santi, L.; Corrêa, A. P. F.; Silva, L. A. D.; Bresciani, F. R.; Schrank, A. y Vainstein, M. H., 2010. The entomopathogen Metarhizium anisopliae can modulate the secretion of lipolytic enzymes in response to different substrates including components of arthropod cuticle. En: Fungal Biology, 114(11-12), pp. 911–916. DOI: https://doi.org/10.1016/j.funbio.2010.08.007
Beys da Silva, W.; Rosa, R.; Berger, M.; Coutinho-Rodrigues, C. J.; Vainstein, M.; Schrank, A.; and Bittencourt, V. y Santi, L. 2020. Updating the application of Metarhizium anisopliae to control cattle tick Rhipicephalus microplus (Acari: Ixodidae). En: Experimental Parasitology, 208, 107812. DOI: https://doi.org/10.1016/j.exppara.2019.107812
Bidochka, M. J.; Mc Donald, M. A.; St.Leger, R.J. y Roberts, D. W., 1994. Differentiation of species and strains of entomopathogenic fungi by random amplification of polymorphic DNA (RAPD). En: Current Genetics, 25, pp. 107-113. DOI: https://doi.org/10.1007/BF00309534
Bischoff, J. F.; Rehner, S. A. y Humber, R. A., 2009. A multilocus phylogeny of the Metarhizium anisopliae lineage. En: Mycologia, 101(4), pp. 512-530. DOI: https://doi.org/10.3852/07-202
Bittencourt, V., 2000. Trials to control South American Ticks with Entomopatogenic Fungi. En: Annals New York Academy of Science, 916, pp. 555-558. DOI: https://doi.org/10.1111/j.1749-6632.2000.tb05335.x
Bittencourt, V. R. E. P.; Bahiense, T. C.; Fernandes, E. K. K. y Souza, E. J., 2003. Avaliação da ação in vivo de Metarhizium anisopliae (Metschnikoft, 1879) Sorokin, 1883 aplicado sobre Brachiaria decumbens infestada com larvas de Boophilus microplus (Canestrini 1883) (Acari: Ixodidae). En: Revista Brasileira de Parasitologia Veterinária, 12(1), pp. 38-42. [Consulta 31 de octubre de 2023]. Disponible en: http://www.ufrrj.br/rbpv/1212003/c12138_42.pdf
Brady, B. L., 1979. Verticilium lecanii (Zimm). Viegas. Descriptions of pathogenic fungi and bacteria. En: Commonwealth Mycogical Institute, 82(811).
Carballo, M. y Guharay, F., eds., 2004. Control biológico de plagas agrícolas. Managua: CATIE. (Serie Técnica. Manual técnico/CATIE, 53). [Consulta 31 de octubre de 2023]. Disponible en: https://bit.ly/3TrkSCz
Carbone, I. y Kohn, L. M., 1999. A method for designing primer sets for speciation studies in filamentous ascomycetes. En: Mycologia, 91, pp. 553-556.
Cardona, Z. A., 2005. Evaluación de Metarhizium annisopleae y Beauveria bassiana sobre los estados de desarrollo de Boophilus microplus. Medellín: Facultad de Ciencias Universidad Nacional de Colombia. (Tesis de Maestría).
Cardozo, H. y Franchi, M., 1994. Epidemiología y control de Boophilus microplus. En: A. Nari, y C. Fiel. Enfermedades parasitarias de importancia económica en Bovinos. Bases epidemiológicas para su prevención y control. pp. 369-402. Montevideo: Hemisferio Sur.
Castro-Janer, E.; Schumaker, T. T. S.; Klafke, G. M., Rifran, L., González, P., Niell, C., Namindome, A.; Gil, A.; Piaggio, J.; Martins, J.R.; Mendes, M. C. y Miller, R. J., 2012. Garrapata: Resistencia a fipronil e ivermectina en rodeos vacunos de Uruguay y Brasil [En línea]. Montevideo: INIA. [Consulta 31 de octubre de 2023]. Disponible en: https://bit.ly/4apbWUi
CONtexto Ganadero, 2023. Ganadería: Control biológico de la garrapata con el uso de hongos patogénicos [En línea]. Bogotá: CONtexto Ganadero. [Consulta: 28 de agosto de 2023]. Disponible en: https://www.contextoganadero.com/ganaderia-sostenible/control-biologico-de-la-garrapata-con-el-uso-de-hongos-patogenicos
Cuore, U., 2006. Resistencia a los acaricidas, manejo y perspectivas [En línea]. XXXIV Jornada de Buiatría. Paysandú, Uruguay (8-10 de junio de 2006). Paysandú: Uruguay. [Consulta 31 de octubre de 2023]. Disponible en: https://bibliotecadigital.fvet.edu.uy/handle/123456789/279
Cuore, U.; Altuna, M.; Cicero, L.; Fernández, F.; Luengo, L.; Mendoza, R.; Nari, A.; Pérez Rama, R.; Solari, M. y Trelles, A., 2012. Aplicación del tratamiento generacional de la garrapata en la erradicación de una población multirresistente de Rhipicephalus (Boophilus) microplus en Uruguay [En línea]. En: Veterinaria, 48(187), pp. 5-13. [Consulta 31 de octubre de 2023]. Disponible en: https://www.revistasmvu.com.uy/index.php/smvu/article/view/204
Cuore, U.; Cardozo, H.; Solari, M. y Cicero, L., 2013. Epidemiologia y control de la garrapata Rhipicephalus (Boophilus) microplus. En: Fiel, C. y Nari, A., eds. Enfermedades parasitarias de importancia clínica y productiva en rumiantes: fundamentos epidemiológicos para su prevención y control. 2a. ed. Montevideo: Hemisferio Sur. pp. 457-484.
Cuore, U. y Solari, M. A., 2014. Poblaciones multirresistentes de garrapatas Rhipicephalus (Boophilus) microplus en Uruguay. En: Veterinaria, 50(193), pp. 4–13. [Consulta: 30 de octubre de 2023]. Disponible en: https://www.revistasmvu.com.uy/index.php/smvu/article/view/247
Cuore, U. y Solari, M., 2022. Manual práctico para el control de la garrapata común del ganado y enfermedades asociadas [En línea]. Montevideo: CEV. [Consulta 31 de octubre de 2023]. Disponible en: https://www.gub.uy/ministerio-ganaderia-agricultura-pesca/comunicacion/publicaciones/manual-practico-para-control-garrapata-comun-del-ganado-enfermedades#
De La Cruz, M. J. y Vahos, Z. R., 2004. Evaluación de los hongos Metarhzium anisoplice y Beauveria bassiana para el control de la garrapata Boophuius microplus a nivel de campo. En: Revista de Investigaciones, 3(1); pp. 75-94. DOI: https://doi.org/10.1016/j.exppara.2011.11.004
Drummond, O. y Whetstone, M., 1969. Oviposition of the gulf coast tick. En: Journal of Economic Entomology, 63(5), pp. 1547-1551. DOI: https://doi.org/10.1093/jee/63.5.1547
Esser, Karl; Lemke, Paul A. y Bennett, J. W., 1994. The Mycota: a comprehensive treatise on fungi as experimental systems for basic and applied research. Berlín: Springer-Verlag.
Errico, F.; Nari, A.; Cuore, U.; Mendoza, R.; Suárez, H.; Mesa, P.; Fernandez, S.; Sosa, E.; Salada, D. y Saporiti, D., 2009. Una nueva ley de lucha contra la garrapata Boophilus microplus en el Uruguay. En: Revista Plan Agropecuario, 131, pp.42–47.
FAO e INRA, 2015. Enfoques innovadores: que vinculan la producción sostenible y agroecológica con mercados en los países en desarrollo. Taller para profesionales e Investigadores [En línea]. Bogotá: Fondo de Cultura Económica. [Consulta: 9 de febrero de 2023]. Disponible en: https://www.fao.org/3/az561s/az561s.pdf
Fassiatiova, O.; Hostounski, Z.; Mixikova, S. y Samsinakova. A., 1978. Hongos entomófagos de plagas en Cuba. La Habana: Instituto de Zoología, Academia de Ciencias de Cuba. pp. 1-14.
Fernándes, E. K., Bitencourt, V. R. y Roberts, D. W., 2012. Perspectives on the potential of entomopathogenic fungi in biological control of ticks. En: Experimental Parasitology, 130(3), pp. 300-305. DOI: httos://doi.org/10.1016/j.exppara.2011.11.004
Fernández, R. M.; Zhioua, E. y García, V. Z., 2005. Infectividad de Metarhizium anisopliae en contra de cepas de garrapata Boophilus microplus sensible y resistente a los organofosforados. En: Técnica Pecuaria en México, 43(3), pp. 433-440.
Fernández-Salas, A.; Alonso-Díaz, M. A.; Alonso-Morales, R. A.; Lezama-Gutiérrez, R.; Rodríguez-Rodríguez, J. C. y Cervantes-Chávez, J.A. 2017. Acaricidal activity of Metarhizium anisopliae isolated from paddocks in the Mexican tropics against two populations of the cattle tick Rhipicephalus microplus. En: Medical and Veterinary Entomology, 31, pp. 36-43. DOI: https://doi.org/10.1111/mve.12203
Fragas, I.; Gema, G. F. e Hidalgo, L., 2006. Formulación de hongos entomopatógenos como control biológico. La Habana: Centro Nacional de Sanidad Agropecuaria.
Frazzon, A. P. G.; Vaz Junior, I. D. S.; Masuda, A.; Schrank, A. y Vainstein, M. H., 2000. In vitro assessment of Metarhizium anisopliae isolates to control the cattle tick Boophilus microplus. En: Veterinary Parasitology, 94(1-2), pp. 117-125. DOI: https://doi.org/10.1016/s0304-4017(00)00368-x
Goettel, M. S. y Inglis, G. D., 1997. Fungi: Hyphomycetes. En: Lacey, L. A., ed. Manual of techniques in insect pathology. Nueva York: Academic Press. pp. 213-249.
Gómez-Beltrán, D. A.; Pérez Montes, J. E. y Villar, D., 2023. Impacto ecológico del insecticida fipronil: valoración de riesgos en humanos. En: Revista Med. Vet. Zoot., 70(1), pp. 65-84. DOI: https://doi.org/10.15446/rfmvz.v70n1.100631
Gindin, G.; Samish, M.; Alekseev, E. y Glazer, I., 2001. The susceptibility on Boophilus annulatus (Ixodidae) ticks to entomopathogenic fungui. En: Biocontrol Science and Technology, 11(1), pp. 111-118. DOI: https://doi.org/10.1080/09583150020029790
Glass, N. L. y Donaldson, G. C., 1995. Development of primer sets designed for use with the PCR to amplify conserved genes from filamentous Ascomycetes. En: Applied and Environmental Microbiology, 61, pp. 1323–1330. DOI: https://doi.org/10.1128/aem.61.4.1323-1330.1995
Gutiérrez, A. C.; Machado, J. A. R.; Hubner‐Campos, R.; Pennisi, M. A.; Rodrigues, J.; López Lástra, C. C.; García, J. J.; Fernandes, É. K. y Luz, C., 2016. Nuevos conocimientos sobre la infección de las ninfas de la cucaracha americana Periplaneta americana con Metarhizium anisopliae sl (Ascomycota: Hypocreales). En: Journal of Applied Microbiology, 121(5), pp. 1373–1383. DOI: https://doi.org/10.1111/jam.13254
Hall, R. A. y Atkey. P. T., 1981. An ultra-structural study of blastospores and conidiospores of Verticillium lecanii. En: Glasshouse Crops Research Institute. Annual report. Littlehampton: Glasshouse Crops Research Institute. pp. 119-120.
Hornbostel, V. L.; Zhioua, E.; Benjamin, M. A.; Ginsberg, H. S. y Ostfeld, R. S., 2005. Pathogenicity of Metarhizium anisopliae (Deuteromycetes) and permethrin to Ixodes scapularis (Acari: Ixodidae) nymphs. En: Experimental and Applied Acarology, 35, pp. 301-316. DOI: https://doi.org/10.1007/s10493-004-5437-z
Humber, R. A., 1997. Fungi: Identification. En: Lacey, L. A., ed. Manual of techniques in insect pathology, pp. 153-158. New York: Academic Press. ISBN: 9780080535777.
Kunz, S. E. y Kemp, D. H., 1994. Insecticides and acaricides: resistance and environmental impact. En: Review Scientific Technology, 13(4), pp. 1249-1286. DOI: https://doi.org/10.20506/rst.13.4.816
López, E.; López, G. y Orduz, S. 2009. Control de la garrapata Boophilus microplus con Metarhizium anisopliae, estudios de laboratorio y campo. En: Revista Colombiana de Entomología, 35(1), pp. 42-46. DOI: https://doi.org/10.25100/socolen.v35i1.9187
Maranga, M.; Kaaya, G.; Mueke, J. y Hassanali, A., 2005. Effects of combining the fungi Beauveria bassiana and Metarhizium anisopleae on the mortality ofthe tick Amblyomma variegatum (Ixodidae) in relation to seasonal changes. En: Mycopathologia, 159, pp. 527-532. DOI: https://doi.org/10.1007/s12223-018-0659-3
Martínez-García, J.; Abad-Zavaleta, J.; García-Gómez, M. y Núñez-Gaona, O., 2023. In vitro evaluation of the acaricidal potential of Beauveria bassiana DS3.17 on the common tick (Rhipicephalus microplus) in Oaxaca, Mexico. En: Revista Mexicana de Ciencias Pecuarias, 14(3), pp. 644-657. DOI: https://doi.org/10.22319/rmcp.v14i3.6265
Ment, D.; Gindin, G.; Glazer, I., Perl, S.; Elad, D. y Samish, M., 2010. The effect of temperature and relative humidity on the formation of Metarhizium anisoplice chlamydospores in tick eggs. En: Fungal Biology, 114(1), pp. 4-56. DOI: https://doi.org/10.1016/j.mycres.2009.10.005
Moreno, R.; Hernández, F.; Benavides, E.; Cotes, A. M.; Romero, A.; Gómez, M. L. y García, L. P., 2001. Evaluación in vitro de Metarhizium anisoplia, Beauveria bassiana y Verticillium lecanii para el control de la garrapata Boophilus microplus (Canestrini) (Mestastigmata: Ixodidae). En: Sociedad Colombiana de Entomología. XVIII Congreso Sociedad Colombiana de Entomología. Pereira, Colombia (8-10 de agosto de 2001). Periera: Colombia.
Nicoletti, R. y Becchimanzi, A., 2020. Endophytism of Lecanicillium and Akanthomyces. agriculture. En: Agriculture, 10(6), 205. DOI: https://doi.org/10.3390/agriculture10060205
Nari, A. y Fiel, C., eds., 1994. Enfermedades parasitarias de importancia económica en bovinos. Bases epidemiológicas para su prevención y control en Argentina y Uruguay. Montevideo: Hemisferio Sur.
Ojeda-Chi, M. M.; Rodríguez-Vivas, R. I.; Galindo Velasco, E. y Lezama-Gutiérrez, R., 2010. Laboratory and field evaluation of Metarhizium anisopliae (Deuteromycotina: Hyphomycetes) for the control of Rhipicephalus microplus (Acari: Ixodidae) in the Mexican tropics. En: Veterinary Parasitology, 170(3-4), pp. 348-354. DOI: https://doi.org/10.1016/j.vetpar.2010.02.022
Ojeda-Chi, M.; Rodríguez-Vivas, R.; Galindo-Velasco, E.; Lezama-Gutiérrez, R. y Cruz- Vázquez, C., 2011. Control de Rhipicephalus microplus (Acari: Ixodidae) mediante el uso del hongo entomopatógeno Metarhizium anisopliae (Hypocreales: Clavicipitaceae). Revisión. En: Revista Mexicana Ciencias Pecuarias, 2(2), pp. 177-192. [Consulta 31 de octubre de 2023]. Disponible: https://www.scielo.org.mx/pdf/rmcp/v2n2/v2n2a5.pdf
Pal, S.; St. Leger, R. J. y Wu, L. P., 2007. Fungal peptide Destruxin A plays a specific role in suppressing the innate immune response in Drosophila melanogaster. En: Journal of Biological Chemistry, 282(12), pp. 8969–8977. DOI: https://doi.org/10.1074/jbc.M605927200
Petraccia, C.; Cardozo, H.; Nari, A. y Solari, M. A., 1983. Estudios de resistencia a garrapaticidas organofosforados (OF) en Boophilus microplus: Resultados obtenidos en cepas de campo llegadas al CI Vet.” Miguel C. Rubino” durante los años 1981 y 1982. En: Veterinaria, 19(83), pp. 5-9. [Consulta 31 de octubre de 2023]. Disponible: https://revistasmvu.com.uy/index.php/smvu/article/view/997
Piralhi-Kheirabadi, K.; Haddadzadeh, H.; Razzaghi-Abyaneh, M.; Bokaie, S.; Zare, R.; Ghazavi, M.; y Shams-Ghafarokhi, M., 2007. Biological control of Rhipicephalus (Boophilus) annulatus by different strains of Metarhizium anisopleae, Beauveria bassiana and Lecanicillium psalliotae fungi. En: Parasitological Reasearch, 100, pp. 1297-1302. DOI: https://doi.org/10.1007/s00436-006-0410-x
Posadas, J. y Lecuona, R., 2009. Selection of native isolates of Beauveria bassiana (Ascomycetes: Clavicipitaceae) for the microbial control of Rhipicephalus (Boophilus) microplus (Acari: Ixodidae). En: Journal of Medical Entomology, 46(2), pp. 284–291. DOI: https://doi.org/10.1603/033.046.0213
Pucheta-Diaz, M.; Flores-Macias, A.; Rodríguez-Navarro, S. y De La Torre, M., 2006. Mecanismo de acción de los hongos entomopatógenos. Caracas, Venezuela. En: Interciencia, 31(12), pp.856-860. [Consulta 31 de octubre de 2023]. Disponible en: https://www.redalyc.org/pdf/339/33901204.pdf
Pulido-Medellin, M. O.; Rodríguez-Vivas, R. I.; García-Corredor, D. J.; Diaz-Anaya, A. y Andrade-Becerra, R., 2015. Evaluación de la eficacia de la CEPA MAF1309 de Metarhizium anisopliar en el control biológico de garrapatas adultas de Rhipicephalus microplus en Tunja, Colombia. En: Revista de la Facultad de Ciencias Veterinarias, 56(2), pp. 75-81. [Consulta 31 de octubre de 2023]. Disponible en: https://ve.scielo.org/pdf/rfcv/v56n2/art04.pdf
Rehner, S. A. y Buckley, E. A., 2005. Beauveria phylogeny inferred from nuclear ITS and EF1-α sequences: evidence for cryptic diversification and links to Cordyceps teleomorphs. En: Mycologia, 97(1), pp. 84–98. DOI: https://doi.org/10.3852/mycologia.97.1.84.
Rijo-Camacho, E., 2011. Control de garrapata del ganado, Boophilus microplus (Canestrini) con hongos entomopatógenos. La Habana: Laboratorio de Entomófagos INISAV.
Rijo, C. E.; Navarro, G.; Rodríguez, R. M. y Murillo, E. Y., 1998. Efectividad de Verticillium lecanii sobre la fase parasítica de la garrapata Boophilus microplus (Acari: Metastigmata Ixodidae). En: Revista Colombiana de Entomología, 24(2), pp. 67- 69. [Consulta 31 de octubre de 2023]. Disponible en: https://bit.ly/3v0wKkN
Rodríguez dos Santos, A., 2003. Una alternativa con hongos entomopatógenos nativos para el control de Trialeurodes vaporariorum (West) en el cultivo de tomate en invernáculos en Uruguay. La Habana: Universidad Agraria de la Habana. (Tesis de doctorado).
Rodríguez dos Santos, A.; Bernardo, J.; Meirelles, R.; Da Silva, R. y Criveletto, C., 2018. Isolamento on farm de fungos patogénicos de hormigas (géneros Atta sp y Acromyrmex sp) y carrapatos (Rhipicephalus). En: Grupo de Agricultura Sustentável. 2º Forum de Agricultura Sustentavel. Goiana, Brasil (20-22 de agosto de 2018). Goiana: Brasil.
Samish, M. y Rehacek, J., 1999. Pathogens and predators of ticks and their potential in biological control. En: Annual Review of Entomology, 44(1), pp. 159-182. DOI: https://doi.org/10.1146/annurev.ento.44.1.159
Samnsinakova, A., 1977. The effects of fungic preparations on larvae of the colorado beetle, Leptinotarsa decemlineata. En: Acta Entomológica Bohemoslovaca, 74(2), pp. 76-80. [Consulta 31 de octubre de 2023]. Disponible en: https://kramerius.lib.cas.cz/view/uuid:be72f4c3-148b-11e1-1729-001143e3f55c?page=uuid:be72f516-148b-11e1-1729-001143e3f55c
Santi, L.; Coutinho-Rodrigues, C. J. B.; Berger, M.; Klein, L. A. S.; De Souza, E. M.; Rosa, R. L.; Guimarães, J. A.; Yates, J. R.; Perinotto, W. M. S.; Bittencourt, V. R. E. P. y Beys-da-Silva, W.O., 2019. Secretomic analysis of Beauveria bassiana related to cattle tick, Rhipicephalus microplus, infection. En: Folia Microbiol., 64(3), pp. 361-372. DOI: https://doi.org/10.1007/s12223-018-0659-3
Santos, M. L.; Pereira, J. R.; Fiorini, L. C.; Duarte, F. C.; Almeida, I. B.; Roma, J., Luiz C.; Soares, Weber V.B.; Bendassolli, R. H.; Almeida, J., E.M. y Mendes, M. C., 2022. Control of cattle tick in pasture with Metharizium anisopliae (IBCB 425). En: Systematic & Applied Acarology, 27(11), pp. 2131–2138. DOI: https://doi.org/10.11158/saa.27.11.1
Schrank, A. y Vainstein, M. H., 2010. Metarhizium anisopliae enzymes and toxins. En: Toxicon, 56, pp. 1267-1274. DOI: https://doi.org/10.1016/j.toxicon.2010.03.008
Shah, P.A., y Pell, J.K. 2003. Entomopathogenic fungi as biological control agents. En: Applied Microbiology and Biotechnology, 61, pp. 413–423. DOI: https://doi.org/10.1007/s00253-003-1240-8
Solari, M. A.; Dutra, F. y Quintana, S., 2013. Epidemiología y prevención de los hemoparásitos (Babesia y Anaplasma) en el Uruguay. En: Fiel, C. y Nari, A. Enfermedades parasitarias de importancia clínica y productiva en rumiantes. Fundamentos para su prevención y control. Buenos Aires: Hemisferio Sur. pp. 657-608.
Souza, C., 2021. Besouro conhecido como “rola-bosta” ganha destaque nas telas e nas pesquisas [En línea]. Lavras: Universidade Federal de Lavras. [Consulta 31 de octubre de 2023]. Disponible en: https://ufla.br/noticias/pesquisa/13164-besouro-conhecido-como-rola-bosta-ganha-destaque-nas-telas-e-nas-pesquisas
St. Leger, R. J., 1993. Biology and mechanisms of insect-cuticle invasion by Deuteromycete fungal pathogens. En: Beckage, N. E.; Thompson, S. N. y Federici, B. A., ed. Parasites and pathogens of insects. San Diego: Academic Press. pp. 211- 229.
Steel, R. G. y Torrie, J. H., 1985. Bioestadística: principios y procedimientos. 2da ed. Nueva York: McGraw-Hill.
Sullivan, C. F.; Parker, B. L. y Skinner, M., 2022. A review of commercial Metarhizium- and Beauveria-based biopesticides for the biological control of ticks in the USA. En: Insects, 13(3), 260. DOI: https://doi.org/10.3390/insects13030260
Tamura, K.; Stecher, G.; Peterson, D.; Filipski, A. y Kumar, S., 2013. MEGA6: Molecular Evolutionary Genetics Analysis Version 6.0. En: Molecular Biology and Evolution, 30(12), pp. 2725–2729. DOI: https://doi.org/10.1093/molbev/mst197
Tofiño Rivera, A. P.; Ortega Cuadros, M.; Pedraza Claros, B.; Perdomo Ayola, S.C. y Moya Romero D.C., 2018. Efectividad de Beauveria bassiana (Baubassil®) sobre la garrapata común del ganado bovino Rhipicephalus microplus en el Departamento de la Guajira, Colombia. En: Revista Argentina de Microbiología, 50(4), pp. 426-430. DOI: https://doi.org/10.1016/j.ram.2017.10.005
Uruguay. Ley 3.606, de 13 de abril de 1910. Diario Oficial [En línea], 26 de abril de 1910. [Consulta: 28 de agosto de 2023]. Disponible en: https://www.impo.com.uy/bases/leyes/3606-1910
Uruguay. Ley 18268, de 17 de abril de 2008. Diario Oficial [En línea], 25 de abril de 2008. [Consulta: 28 de agosto de 2023]. Disponible en: https://www.impo.com.uy/bases/leyes/18268-2008
Uruguay. Ley 19717, de 21 de diciembre de 2018. Diario Oficial [En línea], 23 de enero de 2019. [Consulta: 28 de agosto de 2023]. Disponible en: https://www.impo.com.uy/diariooficial/2019/01/23/12
Uruguay. Ministerio de Ganadería, Agricultura y Pesca. Dirección de Servicios Veterinarios, 1994. Garrapata Boophilus microplpus. Epidemiología y campaña sanitaria. Montevideo: MGAP.
Uruguay. Ministerio de Ganadería, Agricultura y Pesca, 2022. MDR Paysandú: Presentan resultados del proyecto Control Biológico de Garrapata [En línea]. Montevideo: MGAP. [Consulta: 28 de agosto de 2023]. Disponible en: https://www.gub.uy/ministerio-ganaderia-agricultura-pesca/comunicacion/noticias/presentan-resultados-del-proyecto-control-biologico-garrapata
Uruguay. Ministerio de Ganadería, Agricultura y Pesca, 2023a. Capacitación sobre control integrado de garrapata bovina en Curticeiras [En línea]. Montevideo: MGAP. [Consulta: 28 de agosto de 2023]. Disponible en: https://www.gub.uy/ministerio-ganaderia-agricultura-pesca/comunicacion/noticias/capacitacion-sobre-control-integrado-garrapata-bovina-curticeiras
Uruguay. Ministerio de Ganadería, Agricultura y Pesca, 2023b. Nueva jornada sobre control integrado de garrapata bovina en SFR Curticeiras [En línea]. Montevideo: MGAP. [Consulta: 5 de diciembre de 2023]. Disponible en: https://www.gub.uy/ministerio-ganaderia-agricultura-pesca/comunicacion/noticias/nueva-jornada-sobre-control-integrado-garrapata-bovina-sfr-curticeiras.
Verrisimo, C. J., 1995. Inimigos naturais do carrapato parasita dos bovinos. En: Agropecuária Catarinense, 8(1), pp. 35-37.
Verissimo, C. J., 2013. Controle biológico do carrapato do boi, Rhipicephalus (Boophilus) microplus no Brasil. En: Revista de Educação Continuada em Medicina Veterinária e Zootecnia do CRMV-SP, 11(1), pp. 14-23. DOI: https://doi.org/10.36440/recmvz.v11i1.5370
Wang, C. y St Leger, R. J., 2007. The MAD1 adhesin of Metarhizium anisopliae links adhesion with blastospore production and virulence to insects, and the MAD2 adhesin enables attachment to plants. En: Eukaryotic Cell, 6(5), pp. 808–816. DOI: https://doi.org/10.1128/EC.00409-06
Webster, A.; Pradel, E.; Souza, U. A.; Martins, J. R.; Reck, J.; Schrank, A. y Klafke, G., 2017. Does the effect of a Metarhizium anisopliae isolate on Rhipicephalus microplus depend on the tick population evaluated? En: Ticks and Tick-Borne Diseases, 8(2), pp. 270-274. DOI: https://doi.org/10.1016/j.ttbdis.2016.11.012
Wraight, S.P.; Carruthers, R.; Bradley, C. A.; Jaronski, S. T.; Lacey, L. A.; Wood, P. y Galaini-Wraight, S., 1998. Pathogenicity of the entomopathogenic fungi Paecilomyces spp. and Beauveria bassiana against the silverleaf whitefly, Bemisia argentifolii. En: Journal of Invertebrate Pathology, 71(3), pp. 217-26. DOI: https://doi.org/10.1006/jipa.1997.4734
Yari Briones, D. I.; Paredes-Valderrama, J. R.; Milla Pino, M. E. y Murga Valderrama, N. L., 2021. Efecto del hongo entomopatógeno Beauveria bassiana en el control de garrapatosis en ganado bovino. En: Revista de Investigaciones Veterinarias del Perú, 32(5). DOI: http://dx.doi.org/10.15381/rivep.v32i5.19586
Zeina, G. W.; Ahmed, M.; Saeed, M.; Ziena, L. y Laing, M., 2022. Field evaluation of Beauveria bassiana (Balsamo) Vuillemin isolates for the biocontrol of Rhipicephalus microplus (Canestrini) ticks on cattle. En: Experimental Parasitology, 235. DOI: https://doi.org/10.1016/j.exppara.2022.108215


