Se evaluó el efecto de la bajante extrema del agua sobre la reproducción de peces migradores del río Uruguay. Las bajantes extremas del agua producen un efecto negativo en el ictioplancton, y proporcionan nuevos conocimientos sobre la intensidad de este efecto durante periodos consecutivos de sequías. El estudio compara la abundancia y composición del ictioplancton de tres periodos reproductivos consecutivos (octubre-marzo), durante las bajantes extremas del río durante 2020-2023, respecto a información de los 10 años previos (2010-2020) mediante muestreos semanales en cuatro sitios dentro del embalse de Salto Grande. En relación con la década anterior, se observaron disminuciones en las abundancias de P. lineatus (60-85 %), Pseudoplatystoma spp. (52-79 %), L. patí (39-82 %), Pimelodus spp. (24-61 %) y Anostomidae (26-56 %), así como también cambios temporales en la densidad del ictioplancton. A diferencia del periodo previo (2010-2020), cuando se desarrollaban blooms de cianobacterias perjudiciales para los peces durante las sequías estivales, en 2020-2023 no se registraron eventos de floraciones de cianobacterias debido a un fenómeno hidrológico. La ausencia de este efecto perjudicial, sumado a la capacidad de resiliencia de los peces observada durante el periodo previo, genera expectativas razonables para considerar que al finalizar el periodo extremo los peces lentamente recuperan la actividad reproductiva anterior.
Palabras clave: efecto climático, peces potamodromos, ictioplancton.
Avaliou-se o efeito da queda extrema do nível da água sobre a reprodução de peixes migratórios do rio Uruguai. As quedas extremas do nível da água produzem um efeito negativo no ictioplâncton e fornecem novos conhecimentos sobre a intensidade desse efeito durante periodos consecutivos de secas. O estudo compara a abundância e composição do ictioplâncton de três periodos reprodutivos consecutivos (outubro-março), durante as quedas extremas do rio entre 2020-2023, em relação a informações dos 10 anos anteriores (2010-2020) por meio de amostragens semanais em quatro locais dentro do reservatório de Salto Grande. Em comparação com a década anterior, foram observadas diminuições nas abundâncias de P. lineatus (60-85 %), Pseudoplatystoma spp. (52-79 %), L. patí (39-82 %), Pimelodus spp. (24-61 % ) e Anostomidae (26-56 %), bem como mudanças temporais na densidade do ictioplâncton. Diferente do periodo anterior (2010-2020), em que durante as secas de verão ocorriam florações de cianobactérias prejudiciais aos peixes, durante o periodo extraordinário devido a um fenômeno hidrológico, não foram registrados eventos de florações de cianobactérias. A ausência desse efeito prejudicial, somada à capacidade de resiliência dos peixes observada durante o periodo anterior, gera expectativas razoáveis de que, ao final do periodo extraordinário, os peixes lentamente recuperam sua atividade reprodutiva anterior.
Palavras-chave: eventos climáticos, peixes migratórios, ictioplâncton.
Introducción
La Cuenca del Plata (CP) es la quinta cuenca más importante del mundo y la segunda más grande de Sudamérica, detrás de la del Amazonas. Abarca un área de más de 3 millones de kilómetros cuadrados y está integrada por los ríos Paraná, Uruguay y Paraguay. Los caudales de los ríos de la CP son de origen pluvial, donde los mayores aportes provienen de los tramos superiores de la cuenca, con precipitaciones asociadas a los vientos húmedos del Océano Atlántico que pueden alcanzar los 2.500 mm anuales (Comisión Argentina-Paraguaya del río Paraná, 1994; Carolsfeld et al., 2004). El régimen hidrológico de estos ríos alterna periodos de crecidas que desencadenan inundaciones con periodos de estiaje debido a precipitaciones deficitarias que dan lugar a sequías (Camilloni y Barros, 2000; Zaniboni y Schulz, 2004; Penalba y Vargas, 2008). Las variaciones de la altura del agua en los ríos de la CP ejercen un fuerte efecto sobre las características físicas y químicas del agua, tales como la concentración de nutrientes, la transparencia del agua, el pH, el oxígeno disuelto y el carbono orgánico particulado (Villa y Bonetto, 2000). También influyen sobre las comunidades biológicas como, por ejemplo, la abundancia y composición del fitoplancton (O’Farrell et al., 2012), el zooplancton (Boltovskoy et al., 2021) y la ictofauna (Cataldo et al., 2020); o sobre la ocurrencia de floraciones de cianobacterias (O’Farrell et al., 2012; Kruk et al., 2023; Ferrari, 2020). Durante épocas de sequía han sido reportados efectos negativos en la reproducción de peces en general y migradores en particular en los ríos Pilcomayo (Smolders et al.,2000), Paraná superior (Alves et al., 2021), Amazonas (Camacho Guerreiro et al., 2021; Fabré et al., 2017) y Uruguay (Cataldo et al., 2020). Las características de la CP también son afectadas por otros factores no atmosféricos, como el uso del suelo (Saurral et al., 2008) y aportes de residuos domiciliarios de las poblaciones humanas localizadas en sus márgenes sin un adecuado tratamiento.
El río Uruguay alberga más de 150 especies de peces (Menni, 2004; Sverlij et al., 1993), entre las que se encuentran muchas migratorias (potamodromas) de gran importancia ecológica, comercial, pesquera y deportiva. Las especies potamodromas son migradoras obligadas que deben recorrer grandes distancias para reproducirse y así completar su ciclo de vida (de Resende, 2004; Cataldo et al., 2020). Entre las especies de mayor porte se destacan el dorado Salminus brasiliensis, la boga Megaleporinus obtusidens, el sábalo Prochilodus lineatus, el patí Luciopimelodus pati, y los surubíes Pseudoplatystoma corruscans y P. reticulatum (Menni, 2004; Carolsfeld et al., 2004). Con el comienzo de las crecientes anuales de los ríos, los peces migradores forman cardúmenes y se desplazan masivamente en contra de la corriente (migración reproductiva) hasta alcanzar lugares favorables para el desove aguas arriba, considerados áreas reproductivas (Bonetto et al., 1981; de Resende, 2004). En estas áreas los reproductores liberan una gran cantidad de huevos que derivan, con la corriente río abajo, hacia las áreas de cría donde se alimentan y crecen durante uno o dos años (Zaniboni y Schulz, 2004). En este sentido, la altura de los ríos asociados con el caudal del agua es un factor clave en la reproducción de peces migradores.
Los efectos de los cambios del nivel del río sobre las poblaciones de peces migratorios se han evaluado utilizando diferentes aproximaciones. Entre ellas se destacan el estudio de la dinámica poblacional, con marcado y recaptura (Delfino y Baigún, 1985), el análisis del desarrollo gonadal, y el estudio de la abundancia y composición del ictioplancton. Este último es uno de los más recomendados debido a que permite una determinación más precisa de las áreas de reproducción y de cría (Cataldo et al., 2020; Humphries y Lake, 2000; Fuentes y Espinach Ros, 1998; Fuentes et al., 2003). Si bien las especies migratorias están adaptadas a las fluctuaciones del ciclo hidrológico y sincronizan sus migraciones y desoves con los pulsos de inundación (Welcomme, 1985), los periodos de sequías prolongados disminuyen la intensidad y duración de estos pulsos, y afectan negativamente la reproducción de peces y consecuentemente la productividad de las pesquerías (Sverlij et al.,1993; Reynalte-Tataje et al., 2012; Cataldo et al., 2022; Fuentes et al., 2016). De acuerdo con los datos suministrados por el Instituto Nacional del Agua (INA-Argentina), desde comienzos del año 2020 se viene desarrollando una bajante prolongada y extrema en la CP que podría superar la marca histórica de 1.39 m por debajo de cero registrada en 1944 (Borús, 2021). En este sentido, resulta de suma importancia la evaluación de esta tendencia sobre la calidad del agua y las comunidades biológicas afectadas, con énfasis en los peces.
El embalse de Salto Grande es un cuerpo de agua eutrófico que presenta eventos de floraciones de cianobacterias estivales recurrentes (Beron, 1990; Quirós y Luchini, 1983; De León y Chalar, 2003; Chalar, 2006). Los veranos secos están asociados a mayores tiempos de retención del agua que, combinados con el aporte de nutrientes provenientes del río Uruguay y las altas temperaturas que conducen al desarrollo de fuertes estratificaciones verticales del agua, favorecen el desarrollo de blooms de cianobacterias de complejo Microcystis spp. (O’Farrell et al., 2012; Rangel et al., 2012). Estudios del ictioplancton del río Uruguay señalan que la instalación de la represa de Salto Grande, al impedir los desplazamientos de los peces potamodromos, provocó la fragmentación de sus poblaciones a ambos lados de la presa. Y estableció dos áreas reproductivas diferentes e independientes entre sí, ubicadas en la cabecera del embalse y aguas abajo de la presa (Cataldo et al., 2020). Durante los veranos secos, entre los años 2010-2020, las menores densidades de huevos y larvas de peces en la cabecera del embalse de Salto Grande fueron asociadas a los eventos de floraciones de cianobacterias estivales (Paolucci et al., 2017; Cataldo et al., 2020). Las anomalías climáticas asociadas con El Niño-Oscilación del Sur (ENOS) impactan en varios aspectos poblacionales de los peces (Smolders et al., 2000; Alves et al., 2021). En el embalse de Salto Grande, la fase La Niña del fenómeno ENOS fue asociada con las reducciones del caudal de agua y la densidad del ictioplancton, concomitantemente con el desarrollo de blooms de cianobacterias; mientras que la fase húmeda del ENOS (El Niño) promovió el efecto inverso sobre estas variables (Cataldo et al., 2022).
El objetivo general del trabajo fue analizar el efecto de la bajante extrema del agua del río Uruguay durante el periodo 2020-2023 sobre la actividad reproductiva de las especies de peces migradores mediante el análisis espacio temporal del ictioplancton, e identificar posibles zonas de reproducción y cría de estas especies durante el periodo reproductivo en el embalse de Salto Grande. Por último, con el propósito de analizar la magnitud del efecto de la bajante sobre la reproducción de peces durante este periodo extremo, se comparó dicho análisis con una base de datos existente para la misma región (Cataldo et al., 2022). Complementariamente, se exploró el efecto del fenómeno climático El Niño-Oscilación del Sur (ENOS) sobre la abundancia y composición del ictioplancton.
Materiales y Métodos
Área de Estudio
El río Uruguay (31,2 S, 57,9 W) es el segundo afluente más importante de la cuenca del Río de la Plata, después del río Paraná. La cuenca del río Uruguay incluye sectores de Brasil, Uruguay y Argentina, cubre un área de 297.199 km2 y recibe precipitaciones anuales que oscilan entre 1.000 y 2.000 mm (Chalar et al., 2002). Salto Grande es un gran embalse subtropical ubicado en el curso medio del río Uruguay, cogestionado por Uruguay (URU) y Argentina (ARG), construido en 1979 (superficie: 750 km2, longitud media: 120 km, profundidad máxima: 35 m, profundidad media: 6,4 m). Se utiliza principalmente para la generación de energía (capacidad total de 1.890 MW), para el suministro de agua y para actividades recreativas, incluidos los deportes acuáticos y la pesca. Es un cuerpo de agua eutrófico (fósforo total medio: 40 μg l-1, clorofila a: 14,8 μg l-1) y polimíctico, con breves periodos de estratificación durante el verano (O’Farrell et al., 2012). La temperatura del agua superficial oscila estacionalmente entre unos 12 y 30 ℃.
El caudal medio anual de entrada de agua es de unos 5.000 m3 s-1, con registros mínimos y máximos de 434 y 29730 m3 s-1, respectivamente (O’Farrell et al., 2012). La estación del año con menor caudal es la estival, entre enero y marzo (3186 m3 s-1), mientras que los periodos de mayores descargas de agua ocurren entre junio y noviembre (6176 m3 s-1). El tiempo promedio de retención de agua dentro del embalse es de alrededor de 2 semanas (Chalar, 2006), pero durante periodos secos puede aumentar a 9 semanas o más (O’Farrell et al., 2012). En los periodos secos son recurrentes las floraciones estivales de cianobacterias (Chalar et al., 2002). Las cianobacterias de complejo Microcystis son potenciales productoras de cianotoxinas, cuya presencia en el agua es perjudicial para las comunidades acuáticas (Benayache et al., 2019; Osswald et al., 2007). Las concentraciones de microcistinas en el embalse, durante las floraciones de cianobacterias, se han evaluado aunque de forma irregular desde 1999, con concentraciones puntuales durante los periodos estivales de sequías extremas de 200 ugL-1 (Chalar et al., 2002; Bordet et al., 2017).
Muestreos
Los muestreos abarcan tres periodos consecutivos de bajantes extremas durante los años 2020, 2021 y 2023. Los datos de descarga de agua (m3 s-1) para el embalse de Salto Grande fueron proporcionados por el Área de Gestión Ambiental de la Comisión Técnica Mixta de Salto Grande (CTMSG). Las muestras de ictioplancton se recolectaron semanalmente durante el periodo reproductivo de los peces (octubre-marzo) (Cataldo et al., 2020). Se utilizó una red de plancton de malla de 300 μm de poro (apertura de la boca: 50 cm, longitud: 100 cm) equipada con un flujómetro (volumen medio filtrado: 21,2 ± 2,5 m3). Los muestreos se realizaron arrastrando la red contra corriente desde una embarcación en el centro del cauce, durante 10 minutos, a una profundidad de entre 0,5-1,5 m durante el día (entre las 8-12 AM). Las muestras de ictioplancton se preservaron en formaldehído al 5 % inmediatamente después de la recolección y se transportaron al laboratorio para posterior análisis en el microscopio estereoscópico (x12).
Se recolectó un total de 260 muestras de ictioplancton en cuatro sitios de muestreo. El primer punto de muestreo, Bella Unión (BU), se encuentra ubicado en la cabecera del embalse de Salto Grande (a 120 km de la presa), próximo a la ciudad de Bella Unión (URU). Su localización es estratégica ya que el material biológico colectado en este punto proporciona información sobre la actividad reproductiva de los peces aguas arriba del embalse. El segundo sitio, Constitución (CONS), se encuentra localizado a unos 109 km aguas abajo de BU, próximo a la ciudad homónima (URU). Esta estación permite recabar información en un punto relativamente intermedio entre la cabecera del embalse y los sitios más próximos a la presa. El tercer sitio, Itapebí (ITA), se ubica en un brazo del embalse (a 13 km de la presa); y el cuarto sitio se sitúa en el centro del embalse (E1), a 1000 m de la presa (Figura 1).
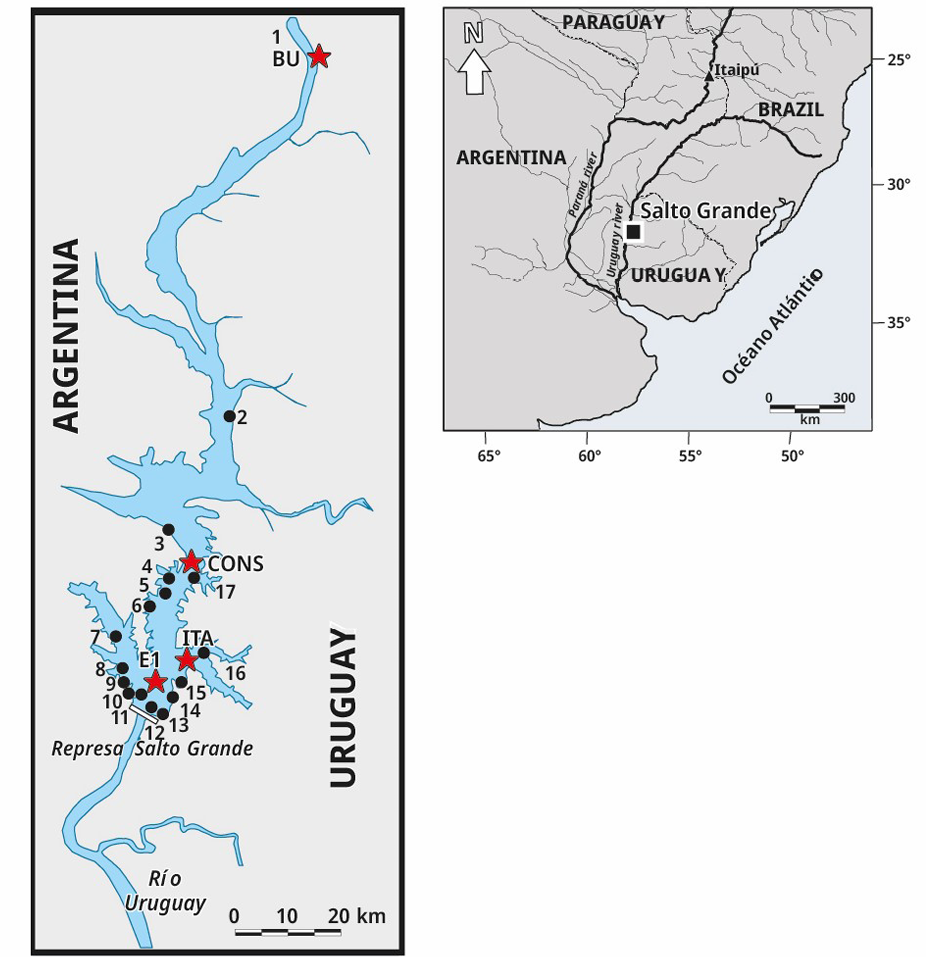
Figura 1. Mapa del embalse Salto Grande y ubicación de los sitios de muestreo del ictioplancton (estrellas rojas) y de cianobacterias (círculos negros).
El estudio analizó la composición de huevos y larvas de peces. Las larvas de peces se identificaron al nivel taxonómico, lo más detalladamente posible (Sverlij et al., 1993; Muñiz Saavedra y Piacentino, 1991; Nakatani et al., 2001). Los estadios larvales de los peces fueron clasificados en dos categorías sobre la base de la presencia o ausencia de vitelo, como larvas viteladas y no viteladas.
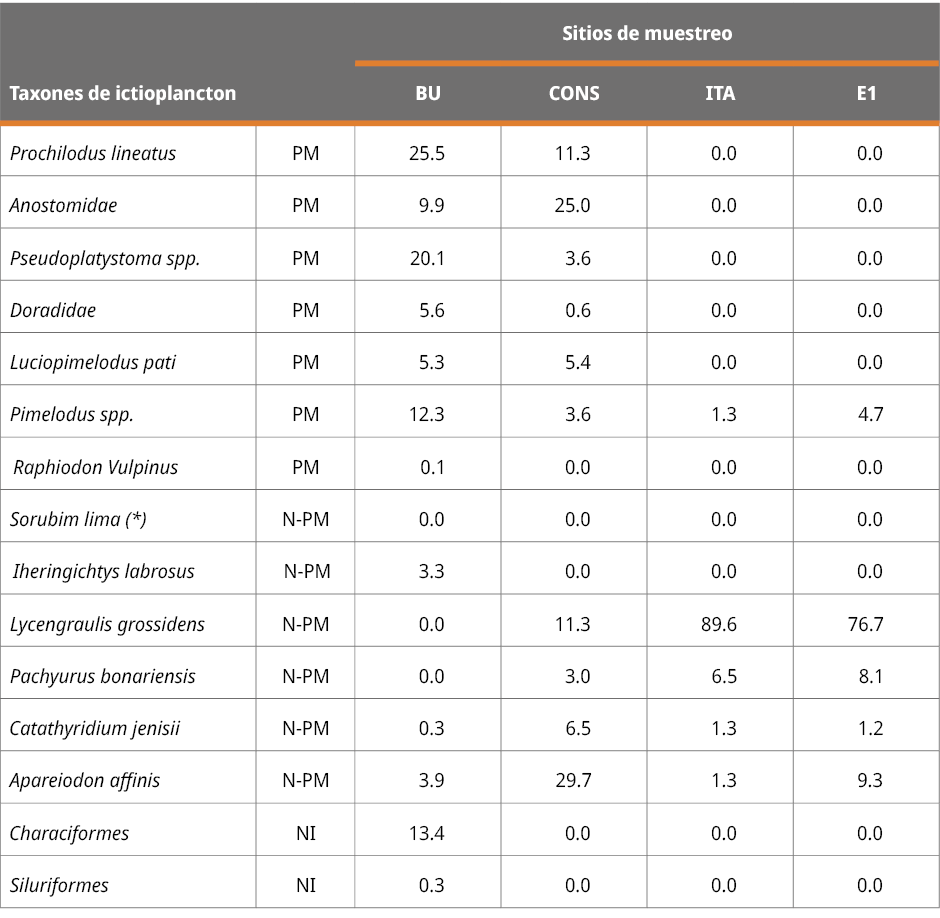
Las especies de peces de agua dulce se clasificaron como migratorias o no migratorias, de acuerdo con Carolsfeld et al. (2004) y Menni (2004). Los ejemplares en etapas muy tempranas de desarrollo (como larvas recién eclosionadas) con los caracteres sistemáticos indistinguibles para su identificación se denominaron larvas no identificadas (NI) (Tabla 1), y no se clasificaron como migratorias o no migratorias. Además, dada la falta de caracteres taxonómicos confiables observados en los huevos de peces, las identificaciones de estos fueron muy limitadas. Estudios de ADN en base al ictioplancton colectado de los mismos sitios de muestreo indicaron que la mayoría de los huevos de peces pertenecen a especies de peces migratorias como P. lineatus y S. brasiliensis y especies de la familia Anostomidae (Cataldo y Paolucci, 2022; y datos inéditos de los autores de este estudio). Las densidades de huevos y larvas de peces se expresan en individuos por metro cúbico de agua (ind. m-3).
Tabla 1. Porcentajes de los grupos taxonómicos encontrados en cada estación de muestreo. PM: peces migratorios (peces potamodromos); N-PM: especie no migratoria y NI: larvas no identificadas (debido a su etapa muy temprana de desarrollo no se distinguen las características sistemáticas). Aclaración: los porcentajes de S. Lima (*) en todos los sitios de muestreo fueron inferiores al 0.02 %.
Las densidades del complejo de cianobacterias dominante (Microcystis spp. y Dolichospermum spp.) se determinaron a partir de muestras colectadas semanalmente, a 20 cm de profundidad, en 17 sitios durante el mismo periodo de muestreo que el ictioplancton (Figura 1). Las muestras se conservaron en frascos de PVC con solución de lugol-yodo al 1 % (O’Farrell et al., 2012; Bordet et al., 2017). Los conteos se realizaron en cámaras según Utermöhl (1958) luego de sedimentar al menos 24 h. Los errores de conteo se estimaron según Venrick (1978), aceptando un máximo de 20 %. Cuando se presentaron espumas densas de fitoplancton los conteos se realizaron con un hemocitómetro Neubauer (0,1 mm de profundidad) bajo microscopio óptico, previa digestión en caliente con hidróxido de sodio para desintegrar las colonias unidas al mucílago (Reynolds y Jaworski, 1978).
Para evaluar la magnitud del efecto de la bajante extrema del agua durante el periodo 2020-2023 sobre el ictioplancton, la densidad y composición de huevos y larvas de peces reportados en este estudio fueron comparadas con la serie de datos previos de ictioplancton provenientes de muestreos multianuales de alta frecuencia colectados del 2010 al 2020, empleando la misma metodología descripta anteriormente (Cataldo et al., 2022).
Los datos mensuales de ENOS, representados por el Índice Oceánico El Niño (ION), se obtuvieron de la Administración Nacional Oceánica y Atmosférica (NOAA, 2021). El ION es calculado como la media móvil de 3 meses de anomalías de SST (temperatura de la superficie del mar reconstruida extendida) en la región de El Niño 3.4, es decir, 5°N–5°S, 120°–170°W (Huang et al., 2017). Valores iguales o superiores a 0,5 ℃ indican eventos de El Niño; valores iguales o inferiores a -0,5 ℃ representan eventos de La Niña, mientras que valores que oscilan entre -0,5 y 0,5 ℃ indican periodos neutrales.
Análisis estadísticos
Las diferencias en las abundancias de ictioplancton (huevos y larvas) y cianobacterias fueron evaluadas utilizando modelos lineales generalizados (GLM), modelando la matriz de covarianza y la heterocedasticidad (Di Rienzo et al., 2020). Se utilizó el análisis residual para probar la normalidad y la homocedasticidad. El criterio de Akaike se empleó como indicador de los modelos más parsimoniosos. Para comparar estas variables entre los sitios de muestreo y los periodos de tiempo se aplicó la prueba de comparación múltiple de LSD de Fisher (Di Rienzo et al., 2020). Se utilizó un análisis de componentes principales (ACP) para ordenar los sitios de muestreo según la abundancia estandarizada de especies y grupos taxonómicos de larvas a fin de evitar resultados sesgados. Con el propósito de caracterizar la composición de grupos taxonómicos de cada sitio de muestreo, en este análisis se excluyeron los individuos cuyos caracteres sistemáticos eran indistinguibles para su identificación debido a sus etapas muy tempranas de desarrollo larvario (ver NI, en Tabla 1).
Este análisis descriptivo caracterizó los sitios de muestreo por diferencias en la abundancia y composición de larvas de especies migratorias y no migratorias. En tanto, el nivel de significancia de los agrupamientos de peces se analizó mediante la prueba de perfil de similitud de SIMPROF. Las relaciones del ION y la abundancia de cianobacterias con las densidades de ictioplancton, huevos y larvas de peces fueron calculadas mediante el análisis de correlaciones de Pearson o Spearman (dependiendo de la normalidad de alguna de las variables). Los análisis estadísticos fueron realizados con el paquete InfoStat® (Di Rienzo et al., 2020) y el paquete estadístico “r” (R4.2.1).
Resultados
Caudal de agua aportado al embalse
La media general del caudal de agua aportado al embalse durante los últimos tres periodos reproductivos consecutivos de los peces entre los años 2020-2023 (Ẋ ± DS; 2020-2021: 2021 ± 1283 m3 s-1; 2021-2022: 1906 ± 1519 m3 s-1; y 2022-2023: 1893 ± 1578 m3 s-1) fue la más baja registrada desde el año 2010. Los valores obtenidos representan una disminución del 64.8 %, 66.8 %, y 67 % respectivamente comparados con el caudal medio entre 2010 y 2020 (5734 ± 2561 m3 s-1) (Figura 2A). La variación mensual de los caudales de agua aportados al embalse señala que, a excepción de los meses de febrero (2021), octubre (2021 y 2022) y marzo (2021), los caudales aportados fueron inferiores al promedio mensual registrado durante los diez años previos (2010-2020) (Figura 2B-C).
Ictioplancton
Se recolectó un total de 4679 huevos y larvas de peces (huevos 24.2 %, n = 1134; larvas 75.8 %, n = 3545). La captura fue mayor durante 2020-2021 (huevos n = 610; larvas n = 1484) que durante el periodo reproductivo posterior 2021-2022 (huevos n = 175; larvas n = 1162) y 2022-2023 (huevos n = 347; larvas = 899). Sin embargo, en todos los periodos (2020-2021, 2021-2022, y 2022-2023) las mayores frecuencias de ocurrencia fueron registradas en la estación BU (94.4 %, 92.4 %, y 91.8 % respectivamente), mientras que los demás sitios presentaron los siguientes porcentajes: CONS: 3.2 %, 3.5 %, y 3.8 %; ITA: 1.3 %, 1.5 %, y 1.6 %; y E1: 1.1 %, 2.6 %, y 2.8 % respectivamente.
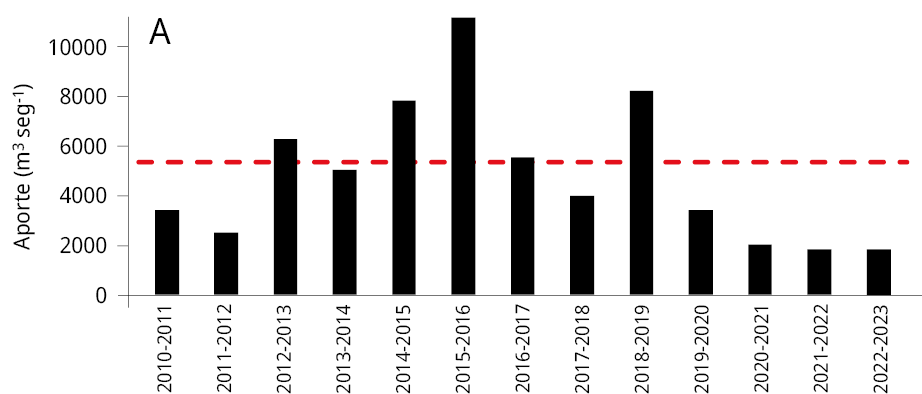
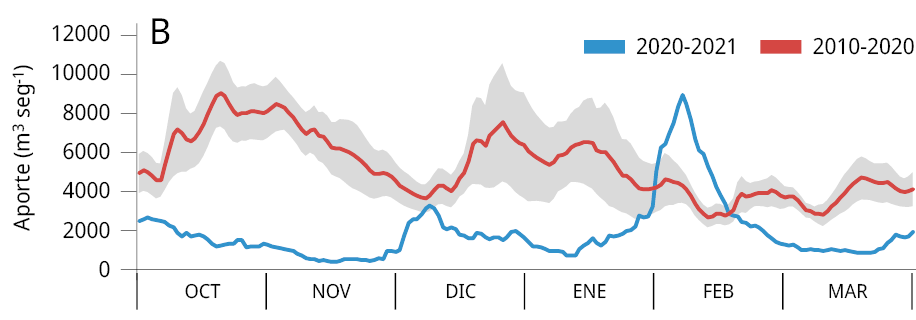
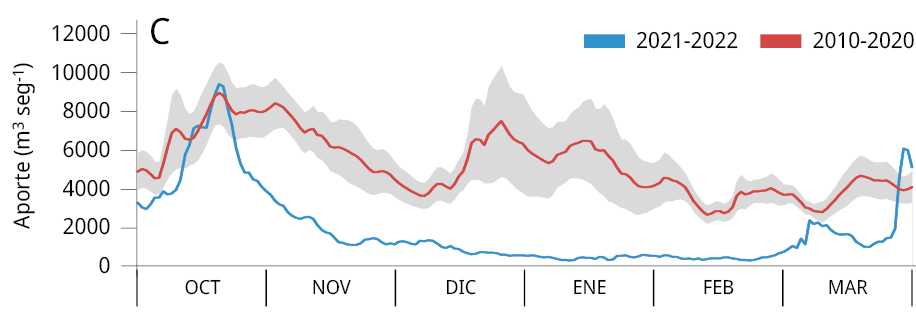
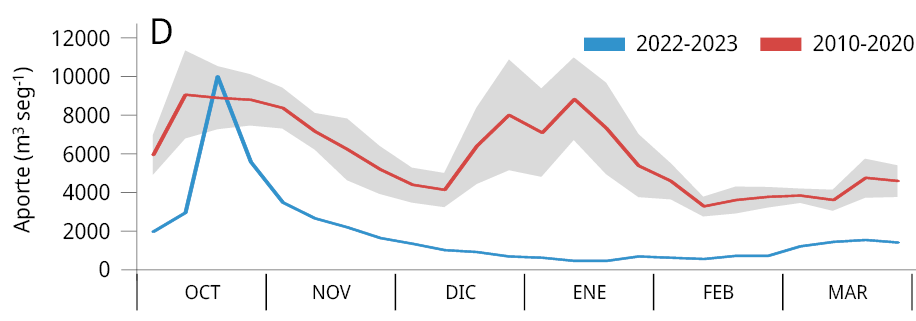
Figura 2. Caudal del río Uruguay en la zona del embalse de Salto Grande (m3s-1). A: medias anuales entre los años 2010 y 2023 (periodo octubre -marzo), la línea punteada roja corresponde a la media anual total desde 2010. Medias mensuales entre, B: 2020-2021, C: 2021-2022 y D: 2022-2023 (línea azul). Las líneas rojas corresponden a las medias mensuales entre 2010-2020 y en gris al desvío estándar de los datos (gráficos B, C y D).
La densidad media anual del ictioplancton difirió significativamente entre periodos reproductivos y sitios de muestreo, siendo más alta en el periodo reproductivo 2020-2021 (4.48 ind. m-3) que en los periodos posteriores 2021-2022 (3.23 ind. m-3) y 2022-2023 (2.73 ind. m-3) (GLM, p < 0,05). En tanto, en cada uno de los periodos reproductivos la densidad media anual del ictioplancton más alta se registró en la estación BU (GLM, p < 0,01; 2020-2021: 4.24 ind. m-3; 2021-2022: 3.07 ind. m-3; y 2022-2023: 2.57 ind. m-3). A su vez, estos valores fueron superiores a los del resto de los sitios de muestreo (CONS: 0.15 ind. m–3; 0.1 ind. m–3, y 0.1 ind. m–3; ITA: 0.05 ind. m–3, 0.04 ind. m–3, y 0.04 ind. m-3; E1: 0.03 ind. m–3, 0.02 ind. m–3, y 0.02 ind. m–3 respectivamente) (LSD de Fisher p < 0,05) (Figura 3).
En todos los periodos reproductivos la densidad de huevos en BU fue significativamente mayor que en el resto de los sitios de muestreo (GLM p < 0,001¸ pruebas LSD de Fisher; p < 0,05). La densidad media de huevos en BU fue de 1.31 huevos m–3 en 2020-2021, 0.43 huevos m–3 en 2021-2022 y 0.78 huevos m-3 en 2022-2023. De manera semejante a lo señalado anteriormente, la abundancia de larvas viteladas (LV) y no viteladas (LNV) en BU fue significativamente mayor (LSD de Fisher; p < 0,05) (2020-2021: LV 1.38 ind. m-3, LNV 1.56 ind. m-3; 2021-2022: LV 1.72 ind. m-3, LNV 0.92 ind. m-3 y 2022-2023: LV 0.99 ind. m-3, LNV 0.80 ind. m-3) que en el resto de los sitios de muestreo. Entre estos últimos tres sitios solo se colectaron LV en CONS (densidades menores a 0.005 ind. m-3), mientras que las densidades de LNV variaron entre 0.02 y 0.14 ind. m-3 en los tres periodos de muestreo.
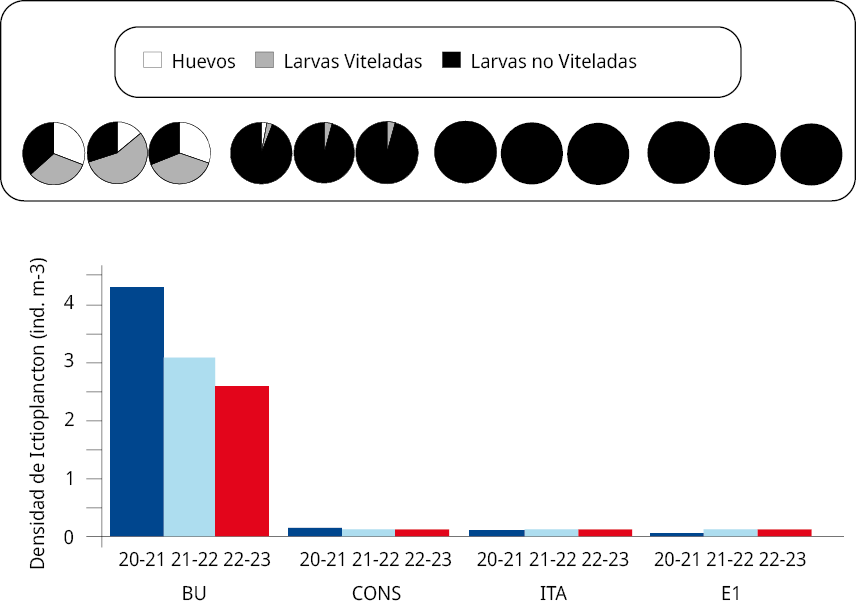
Figura 3. Densidad media del ictioplancton en los sitios de muestreo BU, CONS, ITA y E1, entre octubre y marzo de 2020-2021 (en azul), 2021-2022 (en celeste) y 2022-2023 (en rojo). Los gráficos circulares en la parte superior indican la proporción en porcentaje de huevos de peces (blancos), larvas con saco vitelino (gris) y larvas sin saco vitelino (negras) para cada sitio y año de muestreo.
La composición taxonómica del ictioplancton mostró diferencias significativas durante los tres periodos reproductivos consecutivos entre la estación ubicada en la cabecera del embalse (BU) y los restantes sitios (Test de Simprof P < 0.05). El análisis de ordenamiento de componentes principales indicó que las especies migratorias predominaron en BU, entre las que se destacaron principalmente P. lineatus, Anostomidae, Pseudoplatystoma spp., L. pati, Pimelodus spp., y Doradidae (excepto en 2022-2023); mientras que en los restantes sitios de muestreo las especies no migratorias como Lycengraulis grossidens, Pachyurus bonariensis y Catathyridium jenynsii fueron las más abundantes (Figura 4). S. Lima solo se detectó, con muy escaza presencia, durante el periodo 2020-2021 en BU, CONS y E1.
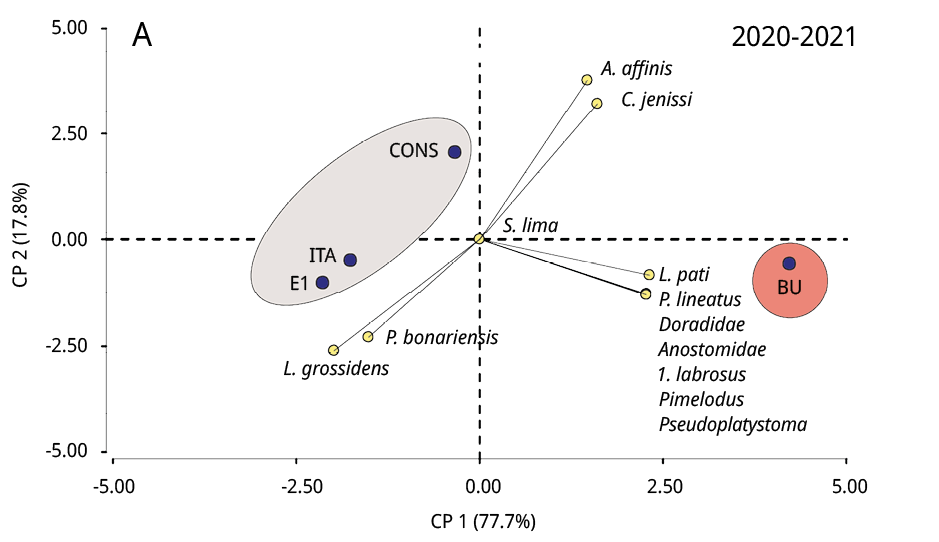
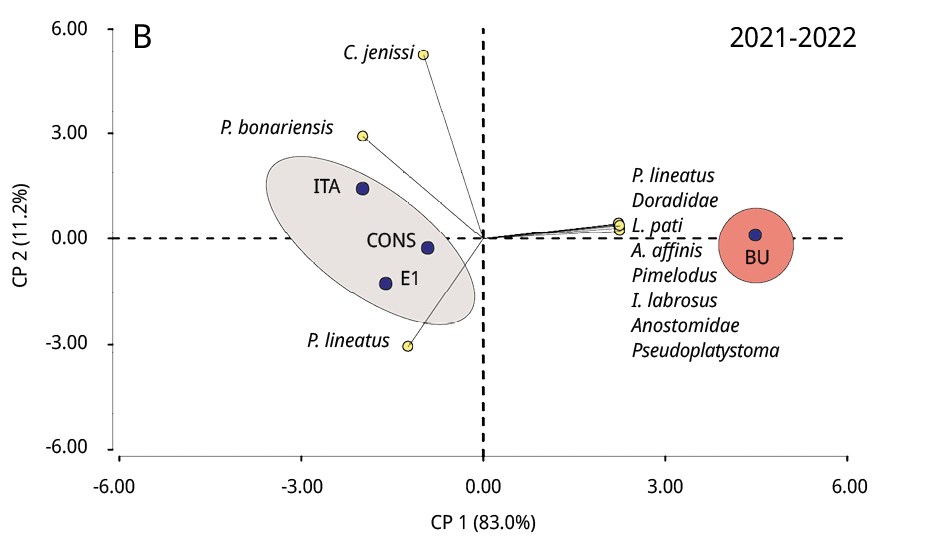
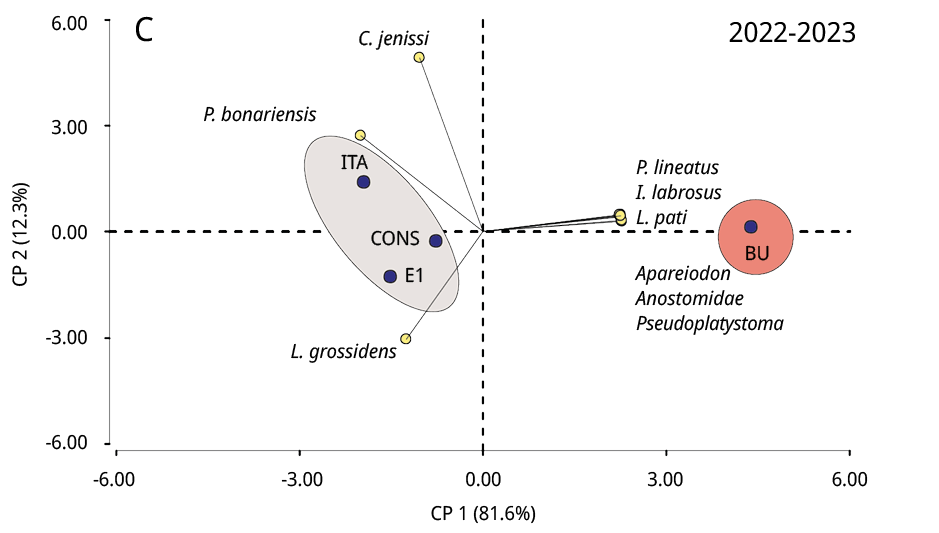
Figura 4. Biplot y análisis de componentes principales de la ordenación de los sitios de muestreo (círculos negros) según la abundancia de taxones de peces (círculos amarillos) de los periodos reproductivos A: 2020-2021, B: 2021-2022 y C: 2022-2023. Las áreas sombreadas de diferentes colores representan diferencias significativas en la composición taxonómica entre BU y los restantes sitios de muestreo (prueba SIMPROF P < 0.05).
Debido a que la mayoría de los huevos y estadios tempranos de desarrollo de las especies potamodromas fueron capturados en la estación de BU, el análisis temporal de la densidad del ictioplancton se realizó en base a la información obtenida a partir de dicho sitio. La variación temporal de la densidad del ictioplancton estuvo asociada al caudal de agua aportado al embalse, pero con diferencias entre años: en los dos últimos periodos reproductivos las mayores densidades de ictioplancton se registraron entre los meses de octubre y noviembre, mientras que durante el primer periodo se observaron entre fines de enero y febrero de 2021 (Figura 5).
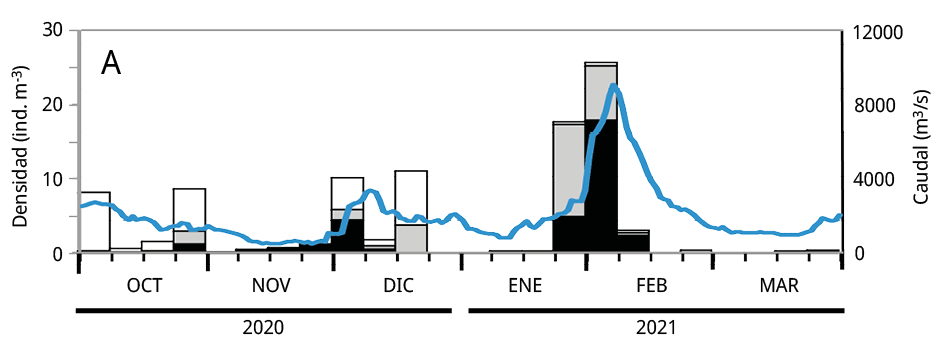
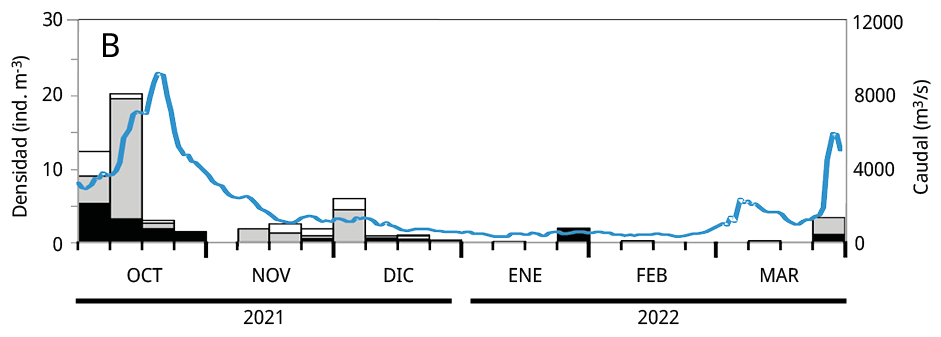
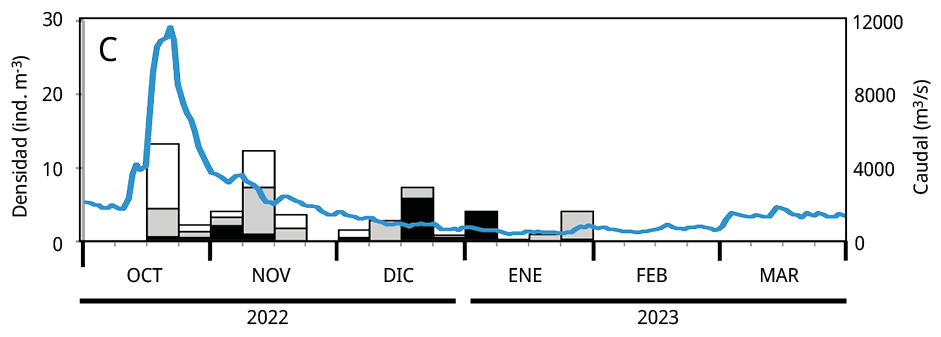
Figura 5. Variación temporal en la densidad semanal de ictioplancton y el caudal de agua aportado al embalse en el sitio Bella Unión durante los periodos reproductivos. A: 2020-2021; B: 2021-2022 y C: 2022-2023. En blanco: la proporción de huevos de peces; en gris las larvas viteladas: en negro las larvas no viteladas. La línea azul: el caudal de agua m3 s-1.
Cianobacterias
Las densidades del complejo de cianobacterias (Microcystis spp. y Dolichospermum spp.) presentaron diferencias entre los periodos estivales analizados (GLM P < 0.01), evidenciando una fuerte disminución con el tiempo (pruebas LSD de Fisher; p < 0,05). Las mayores densidades semanales medias se observaron en 2020-2021 (93153 ± 164789 células ml-1) con un pico máximo de 426860 células ml-1 durante enero de 2021, luego en 2021-2022 con densidades de 869 ± 805 células ml-1 (máximo en marzo de 2022 de 2178 células ml-1). Los niveles medios más bajos de cianobacterias se desarrollaron durante el último periodo (2022-2023) con niveles medios de 110 células ml-1 y máximos durante noviembre de 2022 con densidades de 258 células ml-1.
Periodo de bajantes extremas 2020-2023 vs. periodo previo 2010-2020
El ION se correlacionó positivamente con las densidades de ictioplancton, huevos y larvas de peces entre 2010-2023 (r = 0.34, p = 0.0027; r = 0.32, p = 0.0046; r = 0.54, p= 0.0001 respectivamente). Durante los periodos reproductivos 2010-2020, los valores de ION variaron alternativamente sin mostrar una tendencia definida, mientras que durante 2020-2023 se observaron tres periodos reproductivos consecutivos en fase La Niña (ION < -0.5), en concordancia con la disminución del caudal del agua entre el 65 y 67 %. Un comportamiento análogo al señalado anteriormente se verificó entre la abundancia de cianobacterias y el ictioplancton. Las densidades de cianobacterias se correlacionaron negativamente con el ictioplancton, huevos y larvas de peces durante 2010-2020 (r = -0.41, p = 0.0012; r = -0.40, p = 0.0014; r = -0.41, p = 0.011 respectivamente), mientras que durante 2020-2023 las relaciones funcionales entre ambas variables no fueron significativas en ninguno de los casos. Durante el periodo 2010-2020, la concentración promedio del complejo de Microcystis fue de 86301 ± 246601 células ml-1 (máximo de 1724107 células ml-1), seguida por una reducción significativa durante los tres periodos posteriores (2020-2021: 29124 ± 28347 células ml-1; 2021-2022: 869 ± 805 células ml-1; y 2022-2023: 95 ± 110 células ml-1; GLM p < 0,05¸ pruebas LSD de Fisher; p < 0,05).
La densidad media del ictioplancton durante 2010-2020 fue de 8.1 ± 9.8 ind. m-3, disminuyendo significativamente durante los últimos tres periodos (2020-2021: 4.3 ± 3.5 ind. m-3; 2021-2022: 2.6 ± 3.4 ind. m-3; y 2022-2023: 3.0 ± 2.7 ind. m-3; GLM p < 0,05¸ pruebas LSD de Fisher; p < 0,05). Un comportamiento semejante se produjo con los huevos (H) y larvas de peces: hubo mayores densidades durante 2010-2020 (H: 1.4 ± 2.0 ind. m-3; LV y LNV: 6.6 ± 6.3 ind. m-3) y disminuciones significativas durante los tres periodos posteriores (2020-2021: H: 0.8 ± 1.0 ind. m-3, LV y LNV 4.8 ± 6.6 ind. m-3; 2021-2022: H: 0.4 ± 0.5 ind. m-3, LV y LNV: 2.2 ± 3.0 ind. m-3; 2022-2023: H: 0.8 ± 0.7 ind. m-3, LV y LNV 2.8 ± 0.9 ind. m-3; pruebas LSD de Fisher; p < 0,05; Figura 6).
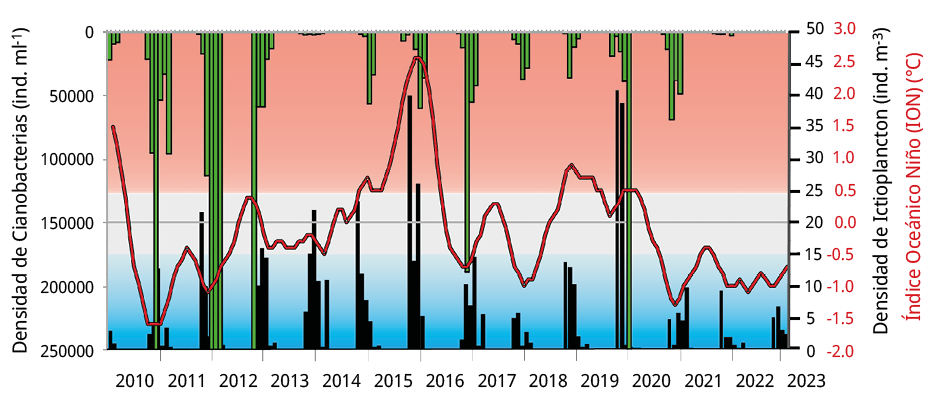
Figura 6. Distribución temporal de la densidad de cianobacterias (ind. ml-1: barras verdes), de la densidad de ictioplancton en el sitio BU (ind. m-3: barras negras) y del Índice Oceánico El Niño (ION, línea roja) durante el periodo de estudio. Valores de ION > 0.5 ℃ corresponden a la fase El Niño (sombreado rojo), valores <-0.5 ℃ corresponden a la fase La Niña (sombreado azul) y valores entre -0.5≤ION≤0.5 corresponden a la fase neutra (sombreado gris) del ENOS.
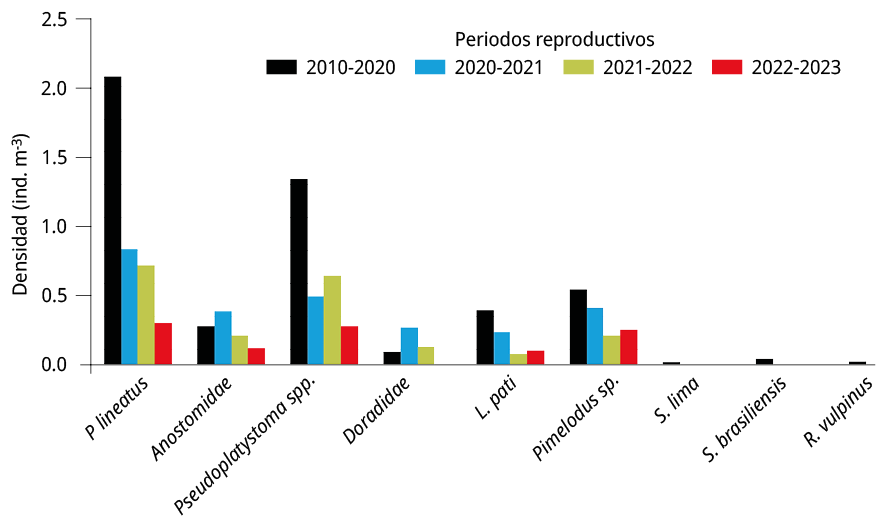
Figura 7. Densidad media anual de larvas de especies potamodromas en la estación BU durante el periodo 2010-2020 (barras negras), y los periodos 2020-2021 (barras azules), 2021-2022 (barras verdes) y 2022-2023 (barras rojas).
Discusión y Conclusiones
Los resultados de este estudio indican que las bajantes extremas del cauce de los ríos en zonas de embalses producen un efecto negativo sobre la densidad del ictioplancton de especies potamodromas, y proporcionan nuevos conocimientos acerca de la intensidad de ese efecto durante periodos consecutivos de sequías. Efectos adversos de las sequías sobre la reproducción de peces en general y migradores en particular han sido reportados en diferentes ambientes de aguas continentales. Smolders et al. (2000) atribuyeron el colapso de la pesquería de sábalo (P. lineatus) en el río Pilcomayo (Bolivia) a la disminución de las descargas fluviales debido a una reducción de áreas de cría en estadios juveniles (Welcomme, 1979). Mientras que en la llanura aluvial del río Paraná superior (Brasil) se reportaron asociaciones positivas del nivel del agua con la abundancia, la riqueza de especies y la estructura de la ictiofauna de los ríos Paraná (represado) e Ivinhema (sin represas) (Alves et al., 2021).
De manera semejante a lo señalado para la Cuenca del Plata, los eventos de sequía provocaron la disminución del crecimiento de Semaprochilodus insignis, una importante especie comercial del Amazonas central (Brasil) (Camacho Guerreiro et al.,2021). Fabré et al. (2017) reportaron que los niveles mínimos de agua que indican las condiciones de sequía influyen en la estructura de tamaño de las comunidades de peces de agua dulce del Amazonas. En tanto, en la selva tropical en Surinam (América del Sur) se observó el secado de lagunas de agua salobre, pantanos de agua dulce y arroyos, provocando la muerte de especies como Ariusherz bergii, A. passany, Centropomus undecimalis, Oreochromis mossambicus, Mugil curema, M. liza, y Megalops atlanticus. También se registraron fallas en la reproducción de tres especies de bagres acorazados de la familia Callichthyidae tanto en pantanos costeros de agua dulce como en un arroyo de selva tropical (Mol et al., 2000).
Los resultados de este estudio corroboran que el área de reproducción de peces migradores se localiza en la cabecera del embalse (BU), tal como fue señalado en estudios previos (Cataldo et al., 2020 y 2022). El efecto de la disminución del caudal de agua durante la bajante extrema afectó de manera heterogénea a las especies o los grupos taxonómicos presentes en el embalse. El análisis de las principales especies migradoras indicó una fuerte disminución de las abundancias de P. lineatus (entre 60-85 %), Pseudoplatystoma spp. (52-79 %), L. patí (39-82 %), Pimelodus spp. (24-61 %), Anostomidae (a excepción del 2021-2022; 26-56 %).
Otras especies migradoras que fueron detectadas durante 2010-2020 en densidades relativamente más bajas, como S. brasiliensis y R. vulpinus (Cataldo et al., 2020), estuvieron ausentes durante el periodo de bajantes extremas 2020-2023. Sin embargo, a pesar de estos bajos niveles de densidades de huevos y larvas de peces presentes en el área de reproducción, la mayor parte de las especies potamodromas lograron reproducirse durante este periodo extremo de sequías.
Diversos factores pueden ser atribuibles al efecto negativo de la disminución del caudal de agua sobre la reproducción de la ictiofauna. En primer término, teniendo en cuenta que el incremento del nivel del agua actúa como un gatillo para la reproducción de peces (King et al., 2003; Agostinho et al., 2004; Cataldo et al, 2020), la ausencia de este factor podría ser la causa de una pobre o nula migración reproductiva. Por otro lado, los periodos de sequía podrían facilitar las actividades depredadoras de los peces piscívoros debido al confinamiento y aumento de la densidad de otras especies ícticas. Una disminución del nivel del agua también podría reducir el intercambio y la conectividad entre las zonas de reproducción, cría de juveniles y alimentación (Rodríguez y Lewis, 1997; Turesson y Bronmark, 2007; Alves et al., 2021; Welcomme, 1979).
La mayor intensidad de la actividad reproductiva de las especies potamodromas durante los diez años previos al presente estudio invariablemente se desarrolló en el periodo octubre-noviembre, concomitantemente al incremento del aporte de agua al embalse durante la primavera (Cataldo et al., 2020). El periodo de sequías, además de afectar la densidad del ictioplancton, produjo cambios temporales en la actividad reproductiva. Por ejemplo, en este trabajo, durante el periodo reproductivo 2020-2021, las mayores densidades de ictioplancton ocurrieron entre fines de enero y mediados de febrero de 2021 asociados al incremento del caudal de agua. Los resultados corroboran la hipótesis de que estas especies de peces dependen temporalmente del nivel hidrométrico para reproducirse (Carolsfeld et al., 2004).
En los veranos secos, durante el periodo 2010-2020, la densidad media de Microcystis spp. en el embalse de Salto Grande fue de 166469 ± 76443 células ml-1, superando el nivel guía de salud pública para las actividades recreativas (100.000 células ml-1) recomendado por la Organización Mundial de la Salud (OMS) (Bartram, 1999; Chorus y Bartram, 1999; Chorus y Welker, 2021). Las densidades semanales más altas en este ambiente coincidieron con fuertes periodos de sequías, con valores de hasta 16627500 células ml-1 en febrero de 2012 (Cataldo et al., 2020). En el embalse de Salto Grande, la concentración de microcistinas totales se correlacionaron con las abundancias de Microcystis spp. y Dolichospermum spp. (Bordet et al., 2017). Las concentraciones de microcistinas suelen ser superiores a 10 μg l-1 durante la mayoría de los periodos secos, registrándose el valor más alto de 621 μg l-1 en octubre de 2012 (Bordet et al., 2017). Estos niveles de microcistinas exceden los valores orientativos de la OMS para el agua potable (1 μg l-1) y las actividades recreativas (10 μg l-1) (Chorus y Bartram, 1999).
Los peces expuestos a microcistinas muestran lesiones hepáticas que resultan en la inhibición de la síntesis de vitelogenina, esencial para producir gametos (Mitsoura et al., 2013). García y Martínez (2012) concluyeron que los juveniles de P. lineatus expuestos, durante 24 y 96 h, a concentraciones de microcistinas entre 1 y 2 mg l-1 muestran afectación en sus defensas antioxidantes, con daños en hígado, branquias y el ADN de las células sanguíneas de los peces. Mediante el análisis de series tiempo (2010-2020), Cataldo et al. (2022) concluyeron que la abundancia de huevos y larvas de peces potamodromas en el embalse de Salto Grande se encuentra inversamente relacionada con la densidad de cianobacterias del complejo Microcystis. Las floraciones de Microcystis han sido implicadas en frecuentes eventos de mortalidad masiva de peces. Otros estudios indican que las floraciones de cianobacterias tienen un impacto negativo en el comportamiento alimentario de las larvas de peces en general y potamodromos en particular (Paolucci et al., 2017; Paolucci yThuesen, 2015), como así también se han reportado efectos negativos sobre la reproducción del molusco invasor Limnoperna fortunei presente en Salto Grande (Boltovskoy et al., 2013), un importante recurso alimentario para especies de peces adultos y sus estadios larvales (Cataldo, 2015; Paolucci et al., 2017).
Uno de los resultados relevantes de esta investigación es que, a pesar de tres periodos estivales consecutivos de sequías extremas con ausencia de caudales de agua superiores a 15000 m3 s-1, no se desarrollaron blooms de cianobacterias en el embalse. Este fenómeno puede deberse a que los bajos niveles de agua produjeron un mayor desacople con suelo circundante de las llanuras aluviales (perímetro húmedo), determinando un menor ingreso de fósforo total (PT) por escorrentía de márgenes y de cursos de agua (Bordet et al., 2023). En consecuencia, a pesar de las excelentes condiciones lumínicas, altas temperaturas y mayores tiempos de residencia del agua durante el periodo extraordinario, la sostenida baja carga interna de fósforo total del embalse de Salto Grande fue insuficiente para subsidiar a las floraciones masivas de cianobacterias (Bordet et al., 2023).
Cataldo et al. (2022) analizaron el efecto del fenómeno ENOS sobre las floraciones de cianobacterias y el ictioplancton en este mismo ambiente, y observaron que la fase La Niña durante el verano de 2012 causó una drástica reducción del número de larvas de peces al mismo tiempo que se desarrollaba una gran floración de cianobacterias. Durante los años siguientes, junto con el aumento del valor del ION y el aporte de agua, las abundancias de huevos y larvas de peces migradores alcanzaron los mayores registros durante el periodo reproductivo 2015-2016, correspondiente a la fase El Niño (Figura 6). Los investigadores concluyeron que los peces migratorios presentan un nivel significativo de resiliencia que les permite adaptarse a los cambios ambientales. Teniendo en cuenta que durante el periodo de bajantes extremas el valor del ION entre octubre y marzo osciló entre -0.7 y -1.3 ℃ (Figura 6), los resultados de este estudio sustentan la hipótesis de que la identificación de las diferentes fases de ENOS se podría utilizar como herramienta predictiva de la actividad reproductiva de los peces migratorios.
A diferencia del periodo previo, donde las sequías se alternaban con ciclos de inundaciones, el efecto negativo de las sequías durante tres periodos consecutivos sobre la actividad reproductiva plantea un interrogante sobre los límites de la capacidad de resiliencia de los peces para adaptarse a extensos periodos críticos. Sin embargo, la ausencia de un posible efecto perjudicial a la exposición de cianotoxinas, sumado a la capacidad de resiliencia de la actividad reproductiva de los peces migradores, permite afirmar que existen expectativas razonables para considerar que al finalizar el periodo prolongado de sequías los peces lentamente recuperen la actividad reproductiva anterior.
Agradecimientos
El autor Daniel Cataldo agradece al Área de Gestión Ambiental de la Comisión Técnica Mixta de Salto Grande (Argentina–Uruguay) por su asistencia en el campo. Este trabajo fue financiado por el STAN CONICET-CTMSG (ST636 y ST6450).
Referencias
Agostinho, A. A.; Gomes, L. C.; Veríssimo, S. y Okada, E. K., 2004. Flood regime, dam regulation and fish in the Upper Paraná River: Effects on assemblage attributes, reproduction and recruitment. En: Reviews in Fish Biology and Fisheries, 14(1), pp. 11–19. DOI: https://doi.org/10.1007/s11160-004-3551-y
Alves, J. C.; Andreotti, G. F.; Agostinho A. A. y Gomes, L., 2021. Effects of the El Niño Southern Oscillation (ENSO) on fish assemblages in a Neotropical floodplain. En: Hydrobiologia, 848, pp. 1811–1823.
Bartram, J., 1999. The World Health Organization in Europe and its role in water and health. En: Environmentalist, 19(1), pp. 17–22. DOI: https://doi.org/10.1023/A:1006528704346
Benayache, N.Y.; Nguyen Quang, T.; Hushchyna, K.; McLellan, K.;Afri- Mehennaoui, F. Z. y Bouaïcha, N., 2019. An overview of cyanobacteria harmful algal bloom (CyanoHAB) issues in freshwater ecosystems. En: Gökçe, Didem, ed. Limnology - some new aspects of inland water ecology. DOI: 10.5772/intechopen.84155
Beron, L., 1990. Features of the limnological behavior of Salto Grande’s reservoir (Argentina-Uruguay). En: Ecological Modeling, 52, pp. 87–102.
Boltovskoy, D.; Bordet, F.; Leites, V.y Cataldo D., 2021. Multiannual trends (2004–2019) in the abundance of larvae of the invasive mussel Limnoperna fortunei and crustacean zooplankton in a large South American reservoir. En: Austral Ecology, 46(8), pp. 1221-1235. DOI: https://doi.org/10.1111/aec.13058
Boltovskoy, D.; Correa, N.; Bordet, F.; Leites, V. y Cataldo, D., 2013. Toxic Microcystis (cyanobacteria) inhibit recruitment of the bloomenhancing invasive bivalve Limnoperna fortunei. En: Freshwater Biology, 58(9), pp. 1968–1981. DOI: https://doi.org/10.1111/fwb.12184
Bonetto, A. A.; Canon Verón, M. y Roldán, D., 1981. Nuevos aportes al conocimiento de las migraciones de peces en el río Paraná. En: ECOSUR,16(8), pp. 29-40.
Bordet, F.; Fontanarrosa, M. S. y O’Farrell, I., 2017. Influence of light and mixing regime on bloom-forming phytoplankton in a subtropical reservoir. En: River Research and Applications, 33(8), pp. 1315–1326. DOI: https://doi.org/10.1002/rra.3189.
Bordet, F.; Collazos, G.; Irigoyen, M.; Simón, C.; Andrade, S. y Vidal, M., 2023.Incidencia de la ausencia de eventos hidrológicos sobre las floraciones de cianobacterias en el Embalse de Salto Grande. En: Universidad de Buenos Aires. IV Congreso Iberoamericano de Limnología y X Congreso Argentino de Limnología: Comprender, proteger y recuperar con equidad las aguas del siglo XXI. Buenos Aires, Argentina (31 de julio - 4 de agosto de 2023). Buenos Aires: UBA.
Borús, Juan; Giordano, Leandro; Vita Sánchez, Maximiliano; Núñez, Víctor; Contreras, Guillermo y Pereira Andrea, 2021. Posibles escenarios hidrológicos en la Cuenca del Plata durante el periodo diciembre 2021 / enero-febrero 2022 [En línea]. Buenos Aires: Ministerio de Obras Públicas. [Consulta: 08 de diciembre de 2021]. Disponible en: https://www.ina.gov.ar/archivos/alerta/Escenario2021_Diciembre.pdf
Camacho Guerreiro, A. I.; Amadio, S. A.; Fabre, N. N. y da Silva Batista, V., 2021. Exploring the effect of strong hydrological droughts and floods on populational parameters of Semaprochilodus insignis (Actinopterygii: Prochilodontidae) from the Central Amazonia. En: Environment, Development and Sustainability, 23, pp. 3338–3348.
Camilloni, I. y Barros V., 2000. The Parana River response to El Niño 1982–83 and 1997–98 events. En: Journal of Hydrometeorology,1, pp. 412–430.
Carolsfeld, J.; Harvey, B.; Ross, C. y Baer, A., 2004. Migratory fish of South America: biology, fisheries and conservation status [En línea]. Ottawa: International Development Research Centre y World Bank. [Consulta: 11 de marzo de 2022]. Disponible en: http://hdl.handle.net/10986/14929
Cataldo, D.; Leites, V.; Bordet, F. y Paolucci, E., 2022. Effects of El NiñoSouthern Oscillation (ENSO) on the reproduction of migratory fishes in a large South American reservoir. En: Hydrobiologia, 849(15), pp. 3259-3274. DOI: https://doi.org/10.1007/s10750-022-04941-6
Cataldo, D. y Paolucci, E., 2022. Estudios ambientales: análisis genéticos de muestras de larvas de peces (OC 7791). Informe técnico. Convenio entre Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET) y la Comisión Técnica Mixta de Salto Grande. Informe final. (Informe inédito). CONICET y CTMSG.
Cataldo, D., 2015. Trophic relationships of Limnoperna fortunei with adult fishes. En: Boltovskoy, D., ed. Limnoperna fortunei: the ecology, distribution and control of a swiftly spreading invasive fouling mussel. Cham: Springer International Publishing. pp. 231-248. ISBN: 978-3-319-13493-2.
Cataldo, D.; Gattás, F.; Leites, V.; Bordet, F. y Paolucci, E., 2020. Impact of a hydroelectric power plant on migratory fishes in the Uruguay river. En: River Research and Applications, 36(8), pp. 1598-1611. DOI: https://doi.org/10.1002/rra.3670
Chalar, G., 2006. Eutrophications dynamics on different temporary scales: Salto Grande Reservoir (Argentina-Uruguay). En: Tundisi, J. G., T. MatsumuraTundisi y C. S. Galli (eds). Eutrofizaçãona América do Sul: causas, consequencias e tecnologias de gerenciamento e controle. Instituto Internacional de Ecología e Gerenciamento Ambiental. [s.l.]: Academia Brasileira de Ciencias, Conselho Nacional de Desenvolvimento Científico e Tecnológico, Inter Academy Panel on International Issues, Inter American Network of Academies of Sciences. pp. 87–101.
Chalar, G.; De Leon L.; Brugnoli E.; Clemente J. y Paradiso M., 2002. Antecedentes y nuevos aportes al conocimiento de la estructura y dinámica del Embalse Salto Grande. En: Fernández-Cirelli, A. C. G., ed. El agua en Sudamérica: de la limnologia a la gestión en Sudamérica. Buenos Aires: Editorial Eudeba. pp. 123–142.
Chorus, I. y Bartram, J.,1999. Toxic cyanobacteria in water: a guide to their public health consequences monitoring and management. Boca Raton: Taylor y Francis Group. ISBN: 0-419-23930-8
Chorus, I. y Welker, M., 2021. Toxic cyanobacteria in water. 2a ed. Boca Raton: CRC Press. ISBN: 978-1-003-08144-9
Comisión Argentina-Paraguaya del río Paraná, 1994. La fauna íctica del río Paraná, tramo Argentino-Paraguayo. [s.l.]: COMIP. ISBN: 987-99076-1-2.
De León, L. y Chalar G., 2003. Abundancia y diversidad del fitoplancton en el Embalse de Salto Grande (Argentina– Uruguay). Ciclo estacional y distribución espacial. En: Limnetica, 22, pp. 103–113.
Delfino, R. y Baigún, C., 1985. Marcaciones de peces en el Embalse Salto Grande, Río Uruguay (Argentina - Uruguay). En: Rev. Asoc. Cienc. Nat. Litoral, 16(1), pp. 85-93.
De Resende, E. K., 2004. Migratory fishes of the Paraguay-Paraná basin excluding the upper Paraná basin. En: Carolsfeld, J.; Harvey, B.; Ross, C. y Baer, A. ed. Migratory fish of South America: Biology, fisheries and conservation status. [s.l.]: World Fisheries Trust, World Bank, IDRC. pp. 99-156. ISBN: 0-9683958-2-12
Di Rienzo, J. A.; Casanoves, F.; Balzarini, M. G.; Gonzalez, L.; Tablada, M. y Robledo, C. W., 2020. InfoStat [En línea]. Versión 2020. Córdoba: Universidad Nacional de Córdoba. [Consulta: 20 de febrero de 2023]. Disponible en: http://www.infostat.com.ar
Fabré, N.; Castello, L.; Isaac, V. J. y Vandick, S. B., 2017. Fishing and drought effects on fish assemblages of the central Amazon Basin. En: Fisheries Research, 188, pp. 157–165.
Ferrari, G. M., 2020. El caudal y la temperatura del agua son los principales factores que regulan el fitoplancton y las floraciones de cianobacterias en un gran río subtropical. En: INNOTEC, (20), pp. 30–66. DOI: https://doi.org/10.26461/20.07
Fuentes, C. M. y Espinach Ros, A., 1998. Variación de la actividad reproductiva del sábalo, Prochiloduslineatus (Valenciennes, 1847), estimada por el flujo de larvas en el río Paraná Inferior. En: Natura Neotropicalis, 29, pp. 25-32.
Fuentes, C. M.; Brow, D. y Paolucci, E. M., 2003. Reproducción del sábalo (Prochiloduslineatus-Valenciennes, 1847) y otras especies de interés comercial y deportivo en el río Uruguay inferior, estimada por la abundancia de estadios larvales en la deriva. [s.l.]: INIDEP. (Informe Técnico N° 80/03)
Fuentes, C. M.; Gómez, M. I.; Brown, D. R.; Arcelus, A. y Espinach Ros, A., 2016. Downstream passage of fish larvae at the Salto Grande dam on the Uruguay River. En: River Res. Applic., 32. pp. 1879–1889. DOI: 10.1002/rra.3030.
García, C. Z. y Martínez, C. B. R., 2012. Biochemical and genetic alterations in the freshwater neotropical fish Prochiloduslineatus after acute exposure to Microcystis aeruginosa. En: Neotropical Ichthyology, 10, pp. 613–622.
Huang, B.; Thorne P. W.; Banzon V. F.; Boyer, T.; Chepurin, G.; Lawrimore, J. H.; Menne M. J.; Smith, T. M.; Vose R. S. y Zhang, H. M., 2017. Extended reconstructed sea surface temperature, version 5 (ERSSTv5): upgrades, validations, and intercomparisons. En: Journal of Climate, 30, pp. 8179–8205.
Humphries, P. y Lake, P. S., 2000. Fish larvae and management of regulated rivers. En: Regulated Rivers Research & Management, 16, pp. 421-432.
King, A. J.; Humphries, P. y Lake, P. S., 2003. Fish recruitment on floodplains: the roles of patterns of flooding and life history characteristics. En: Canadian Journal of Fisheries and Aquatic Sciences, 60(7), pp. 773–786. DOI: https://doi.org/10.1139/f03‐057
Kruk, C.; Segura, A.; Piñeiro, G.; Baldassini, P.; Pérez-Becoña, L.; García-Rodríguez, F.; Perera, G. y Piccini, C., 2023. Rise of toxic cyanobacterial blooms is promoted by agricultural intensification in the basin of a large subtropical river of South America. En: Global Change Biology, 29, pp. 1774-1790. DOI: https://doi.org/10.1111/gcb.16587
Menni, R. C., 2004. Peces y ambientes en la Argentina continental. Vol. 5. Buenos Aires: Museo Argentino de Ciencias Naturales. ISSN: 1515-7652.
Mitsoura, A.; Kagalou, I.; Papaioannou, N.; Berillis, P.; Mente, E. y Papadimitriou, T., 2013. The presence of microcystins in fish Cyprinus carpio tissues. A histopathological study. En: International Aquatic Research, 5(1), pp. 1-8. DOI: https://doi.org/10.1186/2008-6970-5-8
Mol, J. H. D.; Resida, J. S.; Ramlal y Becker, C. R., 2000. Effects of El Niño-related drought on freshwater and brackish-water fishes in Suriname, South America. En: Environmental Biology of Fishes, 59, pp. 429–440.
Muñiz Saavedra, J. y Piacentino, G., 1991. Estudio del desarrollo ontogénico de Odontesthesbonariensis (Cuvier y Valenciennes 1835). En: Medio Ambiente, 11, pp. 61-68.
Nakatani, K.; Agostinho, A. A.; Baumgartner, G.; Bialetzki, A.; Sanches, P. V.; Cavicchioli-Makrakis, M. y Pavanelli, C. S., 2001. Ovos e larvas de peixes de água doce: desenvolvimento e manual de identificação. Maringá: EDUEM. ISBN: 85-85545-73-9
NOAA, 2021. Climate Prediction Center. Maryland: NOAA. [Consulta 3 de mayo de 2021]. Disponible en: https://origin.cpc.ncep.noaa.gov/products/analysis_monitoring/ensostuff/ONI_v5.php
O’Farrell, I.; Bordet, F. y Chaparro, G., 2012. Bloom forming cyanobacterial complexes co-ocurring in a subtropical large reservoir: validation of dominant eco-strategies. En: Hydrobiologia, 698(1), pp. 175-190. DOI: 10.1007/s10750-012-1102-4
Osswald, J.; Rellán, S.; Gago, A. y Vasconcelos, V., 2007. Toxicology and detection methods of the alkaloid neurotoxin produced by cyanobacteria, anatoxin-a. En: Environment International, 33(8), pp. 1070–1089. DOI: https://doi.org/10.1016/j.envint.2007.06.003
Paolucci, E. M. y Thuesen, E. V., 2015. Trophic relationships of Limnoperna fortunei with larval fishes. En: Boltovskoy, D., ed. Limnoperna fortunei: the ecology, distribution and control of a swiftly spreading invasive fouling mussel. Cham: Springer International Publishing. pp. 211-229. ISBN: 978-3-319-13493-2.
Paolucci, E. M.; Leites, V.; Cataldo, D. H. y Boltovskoy, D., 2017. Veligers of the invasive bivalve Limnoperna fortunei in the diet of indigenous fish larvae in a eutrophic subtropical reservoir. En: Austral Ecology, 42(7), pp. 759–771. DOI: https://doi.org/10.1111/aec.12493
Penalba, O. C. y Vargas, W.M., 2008. Variability of low monthly rainfall in La Plata Basin. En: Met. Apps, 15, pp. 313-323. DOI: https://doi.org/10.1002/met.68
Quirós, R. y Luchini, L., 1983. Características limnológicas del embalse de Salto Grande III: Fitoplancton y su relación con parámetros ambientales. En: Revista de la Asociación de Ciencias Naturales del Litoral, 13, pp. 19–66.
Rangel, L. M.; Silva, L. H. S.; Rosa, P.; Roland, F. y Huszar, V. L. M., 2012. Phytoplankton is mainly controlled by hydrology and phosphorus concentrations in tropical hydroelectric reservoirs. En: Hydrobiologia, 693, pp. 13–28. DOI: 10.1007/s10750-012-1083-3
Reynalte-Tataje, D.A.; Agostinho, A.A.; Bialetzki, A.; Hermes-Silva, S.; Fernandes, R. Zaniboni-Filho, E., 2012. Spatial and temporal variation of the ichthyoplankton in a subtropical river in Brazil. En: Environ Biol Fish., 94, pp. 403–419. DOI: https://doi.org/10.1007/s10641-011-9955-3
Reynolds, C. S.y Jaworski, G. H. M., 1978. Enumeration of natural Microcystis populations. En: British Phycological Journal, 13(3), pp. 269–277. DOI: https://doi.org/10.1080/00071617800650331
Rodríguez, M. A. y Lewis, W. M., 1997. Structure of fish assemblages along environmental gradients in floodplain lakes of the Orinoco River. En: Ecological Monographs, 67, pp. 109–128.
Saurral, R. I.; Barros, V. R. y Lettenmaier, D. P., 2008. Land use impact on the Uruguay River discharge. En: Geophys. Res. Lett., 35, pp. 215-235. DOI: 10.1029/2008GL033707.
Smolders, A. J. P.; Van Der Velde, G. y Roelofs, J. G. M., 2000. El Niño caused collapse of the sábalo fishery (Prochiloduslineatus, Pisces: Prochilodontidae) in a South American river. En: Naturwissenschaften, 87, pp. 30–32. DOI: 10.1007/s001140050004
Sverlij, S. B.; Espinach Ros, A. y Orti, G., 1993. Sinopsis de los datos biológicos y pesqueros del sábalo Prochiloduslineatus (Valenciennes, 1847). En: Sinopsis Sobre La Pesca, 154. ISBN: 9253033711
Turesson, H. y Bronmark, C., 2007. Predator-prey encounter rates in freshwater piscivores: effects of prey density and water transparency. En: Oecologia, 153, pp. 281–290.DOI: 10.1007/s00442-007-0728-9
Utermöhl, H., 1958. Zur Vervollkommung der quantitativen Phytoplankton Methodik. En: Mitteilungen der Internationalen Vereinigung der Theoretischen und Angewandten Limnologie, 9, pp. 1–38.
Venrick, E. L., 1978. How many cells to count? En: Sournia, A., ed. Phytoplankton manual. Paris: UNESCO Press. pp. 167–168. ISBN: 92-3-101572-9.
Villar, C. A. y Bonetto, C., 2000. Chemistry and nutrient concentrations of the Lower Paraná River and its floodplain marshes during extreme flooding. En: Archiv fur Hydrobiologie, 148(3), pp. 461-479.
Welcomme, R. L., 1979. Fisheries ecology of floodplain rivers. London: Longman. ISBN: 9780582463103, 0582463106
Welcomme, R. L., 1985. River fisheries. Roma: FAO. (FAO Fish. Tech. Pap. No. 262). ISBN: 92-5-102299-2
Zaniboni, Z. y Schulz, U. H., 2004. Migratory fishes of the Uruguay River. En: Carolsfeld, J.; Harvey, B., Ross, C. y Baer, A., eds. Migratory fishes of South America: biology, fisheries, and conservation status. Washington: World Fisheries Trust, World Bank, IDRC. ISBN: 0-9683958-2-12. pp. 157–194


